Vanuit een naburig ziekenhuis komt een transfer van een 61-jarige man met een klinisch beeld van acute nierinsufficiëntie met oligurie. Een aantal dagen voordien werd hij opgenomen voor acute verwardheid en een infectieus syndroom zonder duidelijke focus. Hij kreeg hiervoor amoxicilline met clavulaanzuur en ciprofloxacine. Kort nadat de antibioticatoediening werd stopgezet, wordt hij anuur.
Uit de voorgeschiedenis weerhouden de artsen, naast een actief ethylgebruik tot een aantal jaren geleden met secundair gedecompenseerde alcoholische levercirrose, ook morbide obesitas, diabetes mellitus en een totale knieprothese rechts. De patiënt kreeg tijdens de opname eenmalig intraveneus contrast toegediend voor een CT-scanonderzoek. Klinisch onderzoek bij transfer toont stigmata van chronisch leverlijden, craqueléeczeem op de onderbenen en een atoon ulcus ter hoogte van het linkeronderbeen. De patiënt zelf vermeldt geen pijnklachten en is koortsvrij. Het lichaamsgewicht bij opname is 110 kg, de bloeddruk is 160/70 mmHg en de polsfrequentie 69 slagen per minuut. Biochemisch onderzoek brengt een licht inflammatoir bloedbeeld aan het licht (leukocytose 9200/μL met 80% neutrofielen en C-reactieve proteïne van 42 mg/L) met een gekende trombopenie (35 10.E9/L) en acute nierinsufficiëntie (met een serum-creatininewaarde van 5,20 mg/dl, wat overeenkomt met een berekende klaring van 11 ml/min volgens CKD-EPI). Verder is er een normaal ionogram en een licht gestoorde leverset met een normaal ammoniak. Urinesediment van een aantal dagen voordien toont 70 WBC/μL en 1000 RBC/ μL met een beperkte proteïnurie. Auto-immuunserologie wijst op een positieve ANF van 1:320 zonder anti- ENA- of anti-DNA-antistoffen, een afwezigheid van complementverbruik en een p-ANCA-titer van 1:80 zonder anti-MPO-antistoffen.
Een echografie van de nieren duidt op een normale niergrootte bilateraal, zonder argumenten voor onderliggende postrenale of vasculaire problematiek. Vanwege de snel progressieve nierinsufficiëntie en het actieve urinesediment besluiten de behandelende artsen om een echogeleide nierbiopsie uit te voeren. Bij anatomopathologisch onderzoek wordt een proliferatieve glomerulonefritis met intracapillaire proliferatie en membranoproliferatie vastgesteld. Aanvullend immunofluorescentieonderzoek wijst op een grof granulaire depositie van zowel IgA, C3 als IgG in de glomerulaire capillaire wand en het mesangium, best passend bij een IgA-dominante postinfectieuze glomerulonefritis. Een aantal dagen later ontwikkelt de patiënt koorts met daarnaast pijn, zwelling en warmte ter hoogte van de rechterknie, waar een totale knieprothese zit. Het gewrichtsvocht bevat 79.154 witte bloedcellen per μL.
Het betreft dus een patiënt met een snel progressieve nierinsufficiëntie op basis van een IgA-dominante postinfectieuze glomerulonefritis en het klinisch beeld van een prothese-infectie.
Oplossing
Hemoculturen en een kweek van synoviaal vocht onthullen de groei van Staphylococcus aureus, m.a.w. de patiënt heeft onderliggend een acute hematogene infectie van een knieprothese.
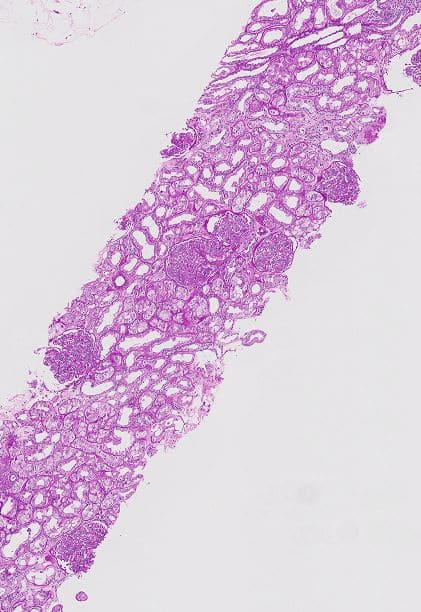
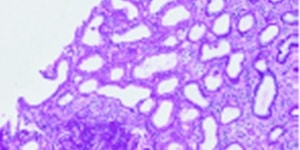
Figuur 1: Overzicht van de PAS-kleuring (Periodic Acid Schiff).

Figuur 2: Detail van de PAS-kleuring: wat opvalt is een toegenomen glomerulaire cellulariteit veroorzaakt door intracapillaire proliferatie van cellen en leukocyteninfiltratie in de capillaire lumina.

Figuur 3: Jones-kleuring: intercapillaire proliferatie en dubbelcontourbeelden met interpositie van materiaal in de glomerulaire capillaire wand.
Een depositie van immuunglobulines en/of complementfactoren kan een glomerulus beschadigen en een inflammatoire respons in gang zetten, wat resulteert in glomerulonefritis. De nieuwe classificatie van glomerulonefritis is gebaseerd op de onderliggende etiologie van de glomerulaire schade (zie tabel 1). IgA-dominante acute postinfectieuze glomerulonefritis is een entiteit in opmars en een morfologische variant van APIGN (Acute PostInfectious GlomeruloNephritis) die vooral voorkomt bij ouderen. Omdat de meerderheid van de casussen beschreven werd in associatie met stafylokokkeninfecties, wordt de term ‘IgA-dominant acute poststaphylococcal glomerulonephritis’ ook wel gehanteerd. Diabetes is de majeure risicofactor, mede gezien de hoge prevalentie van stafylokokkeninfecties bij diabeten.
Dergelijke patienten vertonen typisch symptomen van snel progressief nierfalen, proteinurie en hematurie. De prognose is somber: minder dan 5 percent van de patienten kent een volledig herstel van de nierfunctie. De behandeling bestaat uit corticosteroiden in combinatie met een gerichte antibiotische therapie voor de stafylokokken. Daarnaast is er meestal een niervervangende therapie zoals hemodialyse noodzakelijk.
Een acute periprothetische infectie wordt arbitrair gedefinieerd als de symptomen minder dan 4 tot 12 weken aanwezig zijn (zie tabel 2). Afhankelijk van het type kiem, de duur van de symtomen en de comorbiditeit van de patient is het mogelijk om een dergelijke infectie te eradiceren aan de hand van een agressieve lokale behandeling (open spoeling met polyethyleenwissel) en een langdurige systemische behandeling, zonder de prothese te verwijderen. Bij acute hematogene infecties is de verwekker meestal Staphylococcus aureus of een streptokok.
In deze casus besloten de artsen de periprothetische infectie te behandelen via een open spoeling van de knie met een polyethyleenwissel en uitgebreide kweeknames. De antibioticatherapie bestond uit flucloxacilline 6 g/24 uur via continue infusie, geassocieerd met rifampicine in een dosis van 600 mg daags per os bij het negatief worden van de hemoculturen. Na een systemische behandeling schakelde men over naar ciprofloxacine, gedoseerd in 500 mg tweemaal daags per os, waarbij de rifampicine werd aangehouden. De patient evolueerde snel naar een terminaal nierfalen, waarvoor de artsen intermittente hemodialyse opstartten. Eenmalig kreeg hij een bolus Solu-Medrol van 1 g toegediend, gevolgd door hooggedoseerde Medrol (64 mg per dag). Gezien er geen renale recuperatie optrad, werd deze behandeling na twee weken gestaakt.
Samenvattend: bij de vaststelling van een IgA-dominante postinfectieuze glomerulonefritis dient steeds gezocht te worden naar een onderliggende infectieuze focus. In deze casus kwam de focus niet meteen duidelijk naar voren, vermoedelijk omdat de inname van antibiotica in het vorige ziekenhuis de infectie deels maskeerde. De therapie bestaat enerzijds uit het behandelen van de onderliggende glomerulonefritis met corticosteroiden, anderzijds uit het onder controle houden van de onderliggende infectie. Bij een acute periprothetische infectie zijn een snelle verwijzing naar een gespecialiseerd orthopedisch chirurg en een nauwe samenwerking tussen chirurg en infectioloog of medisch microbioloog van cruciaal belang.
Tabel 1: Classificatie van glomerulonefritis
De term glomerulonefritis omvat ziektebeelden gekarakteriseerd door een toegenomen glomerulaire cellulariteit, veroorzaakt door de proliferatie van cellen en/of
leukocyteninfiltratie. Op basis van een anatomopathologisch onderzoek (lichtmicroscopie en immunofluorescentieonderzoek) maakt men een onderscheid in vijf klassen.
| Pathogenese | Specifieke ziekte-entiteit |
|---|---|
Immunocomplex GN
|
IgA-nefropathie, IgA-vasculitis, lupus nefritis, infectiegerelateerde GN (o.a. IgAdominantepostinfectieuze GN), fibrillaire GN met polyclonale Ig-depositie |
Pauci-immune GN
|
MPO-ANCA-GN, proteinase-3-ANCA-GN, ANCA-negatieve GN |
Anti-GBM-GN
|
Anti-GBM-GN |
Monoclonale Ig-GN
|
Monoclonale Ig-depositieziekten, proliferatieve GN met monoclonaleimmunoglobuline deposits, immunotactoïde glomerulopathie, fibrillaire GNmet monoclonale Ig-deposits |
C3-glomerulopathie
|
C3-GN, dense deposit disease |
GN = glomerulonefritis; Ig = immunoglobulines; IF = immunofluorescentieonderzoek; GBM = Glomerulaire Basale Membraan
Tabel 2: Korte schematische aanpak van acute en chronische prothese-infecties
| Type infectie | Behandeling |
Acuut
|
Open spoeling met polyethyleenwissel versus revisie TKP (1-stage of 2-stage) (afhankelijk van type kiem) |
|---|---|
|
Chronisch (> 3 maanden na index chirurgie) |
1-stage of 2-stage revisie TKP |
Voor meer informatie:
dr. Sara Ombelet & dr. Jens Van Praet
dienst Inwendige Ziekten
dr. Pieter-Jan Vandekerckhove
dienst Orthopedie
Referenties
1. Osmon, D.R., Berbari, E.F., Berendt, A.R., Lew, D., Zimmerli, W., Steckelberg, J.M., Rao, N., Hanssen, A., Wilson, W.R. (2013). ‘Diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America’. Clinical Infectuous Diseases, 56(1), e1-25.
2. Sethi, S., Haas, M., Markowitz, G.S., D’Agati, V.D., Rennke, H.G., et al. (2015). ‘Mayo Clinic/Renal Pathology Society Consensus Report on Pathologic Classification, Diagnosis, and Reporting of GN.’, Journal of the American Society of Nephrology, Nov 13.
3. Nasr, S.H., D’Agati, V.D. (2011). ‘IgA-dominant postinfectious glomerulonephritis: a new twist on an old disease.’, Nephron Clinical Practice, 119(1),c18-25.
4. Gehrke, T., Alijanipour, P., Parvizi, J. (2015). ‘The management of an infected total knee arthroplasty.’, The Bone & Joint Journal,97-B: pp.20-29.
Download het artikel als PDF-bestand.
Copyright © 2016 AZ Sint-Jan Brugge-Oostende AV. Alle rechten voorbehouden. De inhoud (zowel teksten als afbeeldingen) van dit magazine is auteursrechtelijk beschermd. Niets uit deze uitgave mag vermenigvuldigd of doorgegeven worden aan derden zonder schriftelijke toelating van de uitgever.