Wat is endoscopische submucosale dissectie?
Met endoscopische submucosale dissectie (ESD) worden via een endoscopische toegangsweg en-bloc resecties verricht van oppervlakkige tumoren of grote goedaardige letsels (uitgaande van de mucosa en/of de oppervlakkige submucosa; Figuur 1) in de slokdarm, de maag en het colorectum. ESD werd initieel ontwikkeld in Japan in het begin van de jaren ’90 als een minder invasief alternatief voor chirurgie voor de behandeling van oppervlakkige tumoren van het maagslijmvlies. In tegenstelling tot in Westerse landen is er in Japan uitgebreide expertise in het behandelen van vroegtijdige carcinomen van de maag.
Dit hangt samen met de hogere incidentie van maagcarcinoom (omwille van demografische en dieetfactoren) en met een endoscopisch screeningsprogramma, waardoor een groot deel van de patiënten in een vroeg stadium gediagnosticeerd worden. Japanse endoscopisten konden een grote expertise opbouwen, waarbij ESD al snel ook toegepast werd in andere delen van de gastro-intestinale tractus zoals de slokdarm en het colorectum. De ESD-techniek werd nog maar recent in het Westen geïntroduceerd en wordt nog niet op grote schaal uitgevoerd.
Hoe verloopt de procedure?
De procedure gebeurt over het algemeen onder algemene narcose bij een volledig gecurariseerde patiënt. CO2 insufflatie is onmisbaar gezien dit gas vlotter vanuit het lumen doorheen de darmwand diffundeert en zo het risico op complicaties (overinsufflatie en perforatie) vermindert.
Bij de start van de procedure (Figuur 2)
wordt het letsel gemarkeerd met verschillende kleine coagulatiepunten (met ook een marge van enkele millimeters normaal weefsel). Via submucosale injectie met een mengsel van gelofusine met enkele druppels methyleenblauw en adrenaline wordt het letsel “gelift”, voldoende verwijderd van de muscularis propria om het risico op perforatie te verminderen.
Vervolgens gebeurt een circulaire incisie rond de markagepunten (zodat het gehele letsel zeker met voldoende marge verwijderd wordt), waarna men met een elektrochirurgisch mesje (dat doorheen het werkkanaal van de endoscoop opgevoerd wordt), de letsels vrij disseceert van de muscularis propria en stapsgewijs en-bloc verwijdert (Figuur 2).
De resectiespecimens worden georiënteerd, vastgepind, gefixeerd en onderzocht door de anatoom-patholoog. De diepe en laterale resectie marges worden gemarkeerd met zwarte inkt. Het specimen wordt aangesneden in coupes met 2 mm intervallen, waarna de patholoog zorgvuldig de histologie, invasiediepte, laterale en diepe snijranden alsook aanwezigheid van lymfovasculaire invasie beoordeelt (Figuur 3).
En-bloc vs. piecemeal resectie
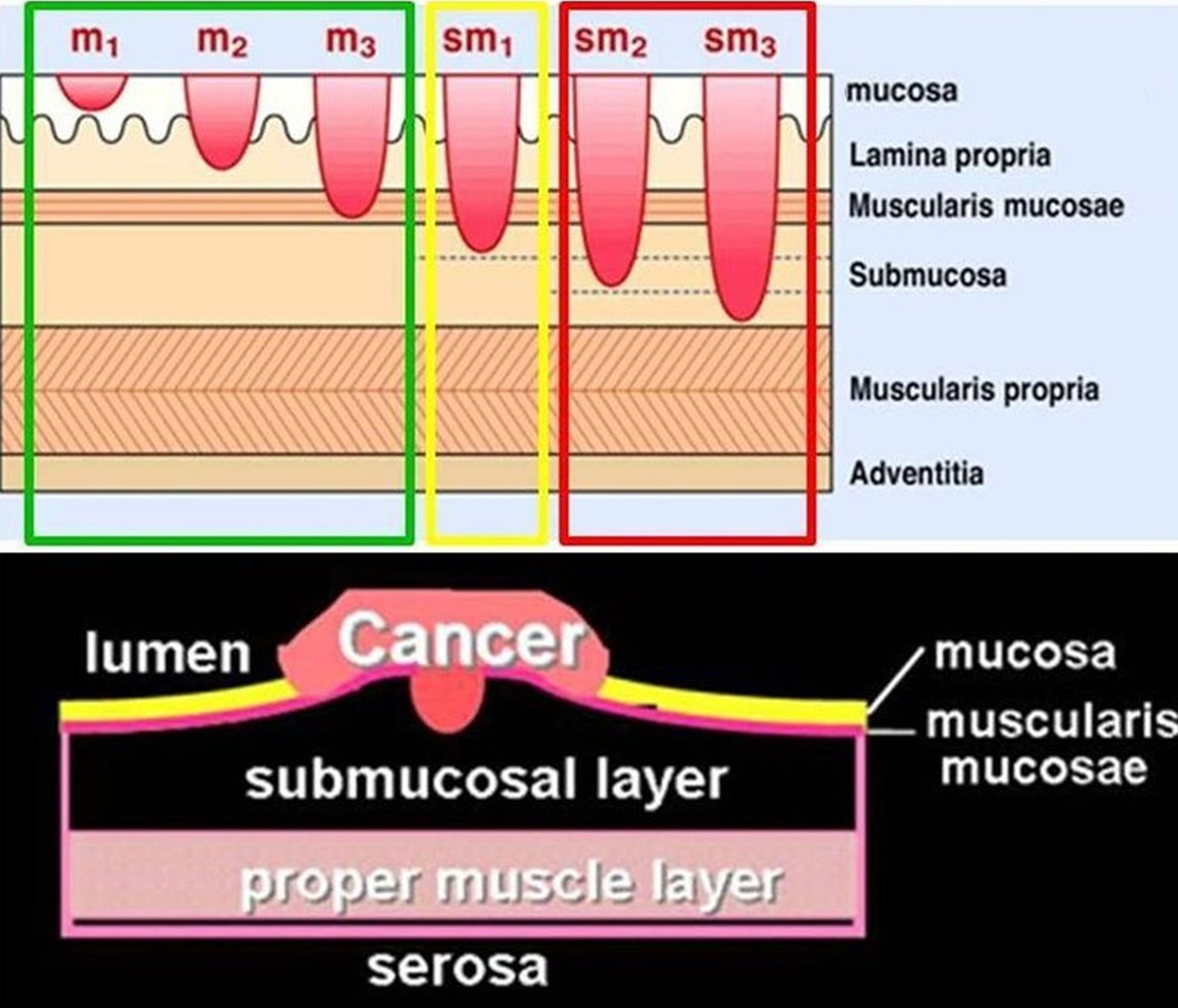
Het voordeel van een en-bloc resectie is dat één groot resectiespecimen een accurate histologische staging toelaat en – in het geval van vrije laterale en diepe snijranden (de zogenaamde ‘R0 resectie’) – endoscopische curatie mogelijk maakt voor oppervlakkige goed gedifferentieerde tumoren of voor grote benigne letsels, waarbij men anders (bij piecemeal resectie in verschillende fragmenten) aanvullende heelkunde zou voorstellen. Het grote nadeel van in ‘stukken’ (d.i. piecemeal) te reseceren, is dat dit de histologische evaluatie betreffende diepte en lymfovasculaire invasie zeer moeilijk maakt (Figuur 4a en 4b en 5a b c).
Bij piecemeal resectie (ook wel genoemd piecemeal endoscopische mucosale resectie; piecemeal-EMR) kan de reële uitgebreidheid en invasiediepte onderschat worden, wat potentieel noodzakelijke aanvullende therapie kan verhinderen (bijvoorbeeld bij piecemeal-EMR van een slecht gedifferentieerd diep submucosaal invaderend letsel kan de diepte en de differentiatiegraad onderschat worden, waarbij in dergelijke gevallen echter heelkunde dient voorgesteld te worden gezien het verhoogde risico op lymfeklieraantasting).
In veel gevallen biedt ESD dus duidelijk een meerwaarde ten opzichte van de klassieke piecemeal-EMR, gezien dit correcte informatie oplevert over diepe en laterale snijranden en zo ook een correcte inschatting over de nood aan eventuele aanvullende therapie mogelijk maakt (Figuur 6). Endoscopische en-bloc R0 resectie reduceert de kans op lokaal recidief tot quasi 0, en zo ook de nood aan nieuwe endoscopische en/of heelkundige interventies.
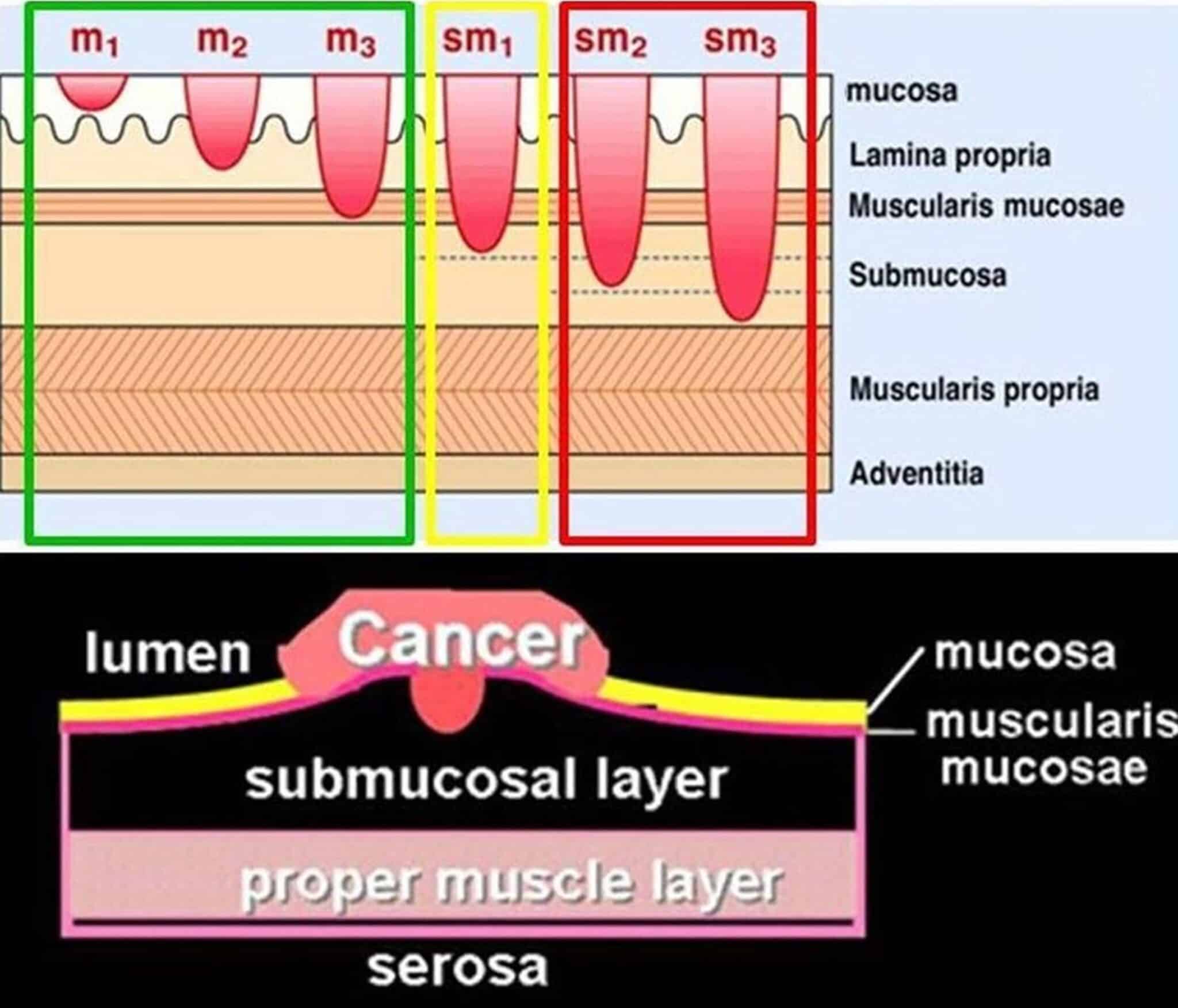
Fig.1: Schematische voorstelling van de verschillende lagen van de darmwand met mucosa, muscularis mucosae, submucosa, muscularis propria en adventitia/serosa. Tumoren in de oppervlakkige mucosa worden ingedeeld naar m1, m2 en m3 waarbij m3 tumoren invaderen tot in de muscularis mucosae (de overgang tussen mucosa en submucosa). Gezien er bv. in het colon geen lymfevaten zijn in de mucosa kan een oppervlakkig mucosaal carcinoma in principe endoscopisch curatief behandeld worden omdat er quasi geen kans is op lymfeklieraantasting. Hoe dieper de invasie in de wand (bv. sm1, sm2, sm3 – onderverdeling naar diepte in de submucosa), hoe groter de kans op lymfeklieraantasting. In het colon wordt bv. een diepte van maximaal 1000 µm in de submucosa aanvaard.

Fig.2: Schematische voorstelling van het verloop van een ESD procedure.
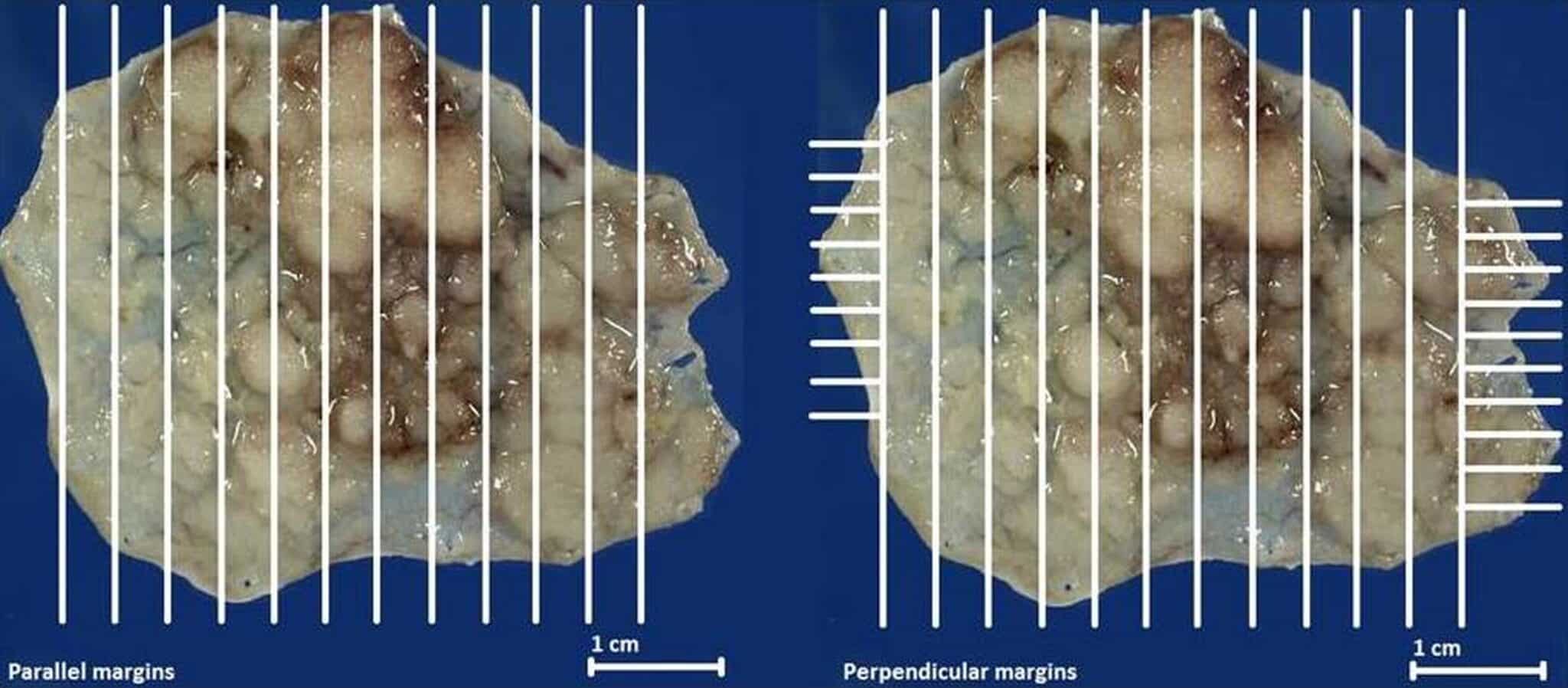
Fig. 3: Bij het histopathologisch nazicht wordt het resectiespecimen aangesneden met 2 mm interval in evenwijdige parallelle coupes en ook in dwarse coupes ter hoogte van de randen om een correcte inschatting te kunnen maken van de vrije laterale snijranden.
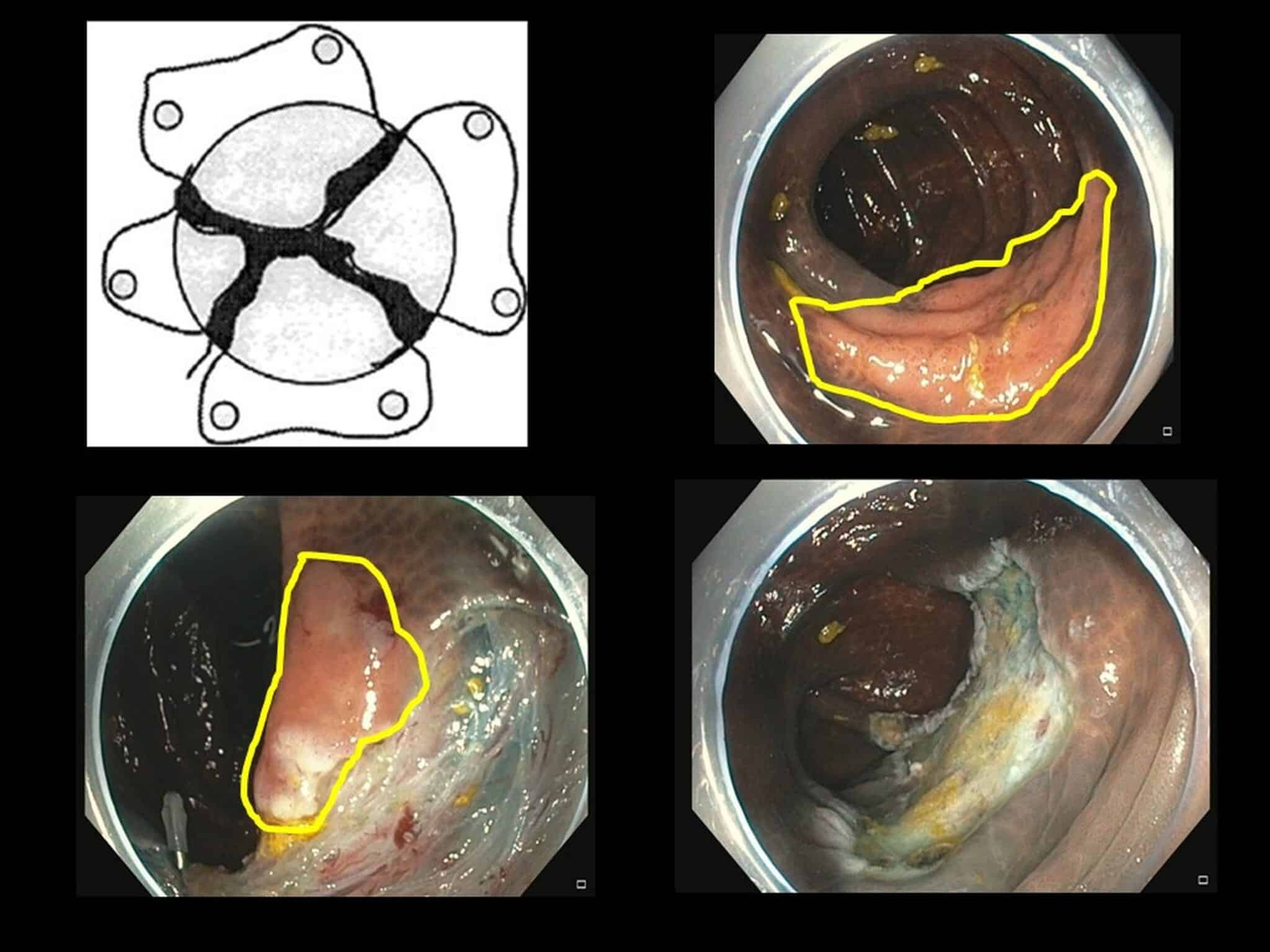
Fig.4a: Schematische voorstelling van een piecemeal EMR van een vlakke poliep (geel afgelijnd) in het colon. Deze poliep wordt dus in “hapjes” met een lus verwijderd. In het endoscopisch beeldje in het midden ziet men nog een klein restje poliepweefsel dat ook geel afgelijnd is. Het 3e endoscopisch beeldje toont het resectieulcus op het einde van de procedure waarbij er geen poliepweefsel meer macroscopisch te weerhouden is. Deze poliep ziet er volledig goedaardig uit en dus werd beslist om deze piecemeal te reseceren; indien er foci van maligne ontaarding zouden geweest zijn, zou het moeilijk zijn om in te schatten of de EMR “curatief” is.
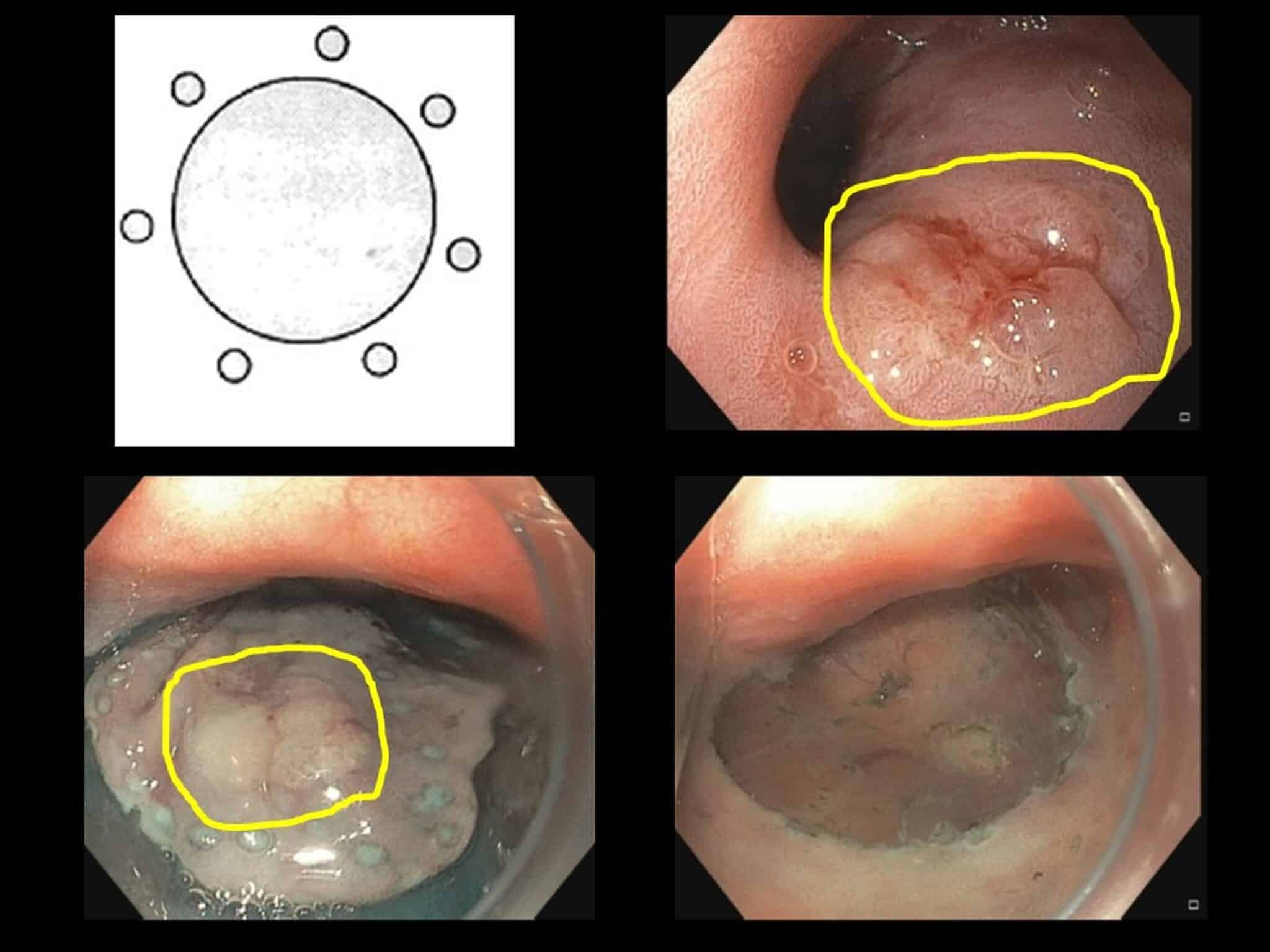
Fig.4b: Verdacht licht verheven letsel in een Barrett slokdarm dat en-bloc verwijderd wordt (finale diagnose: hooggradige dysplasie met negatieve snederanden).
Indicaties:
Colonpoliepen: typevoorbeeld van endoscopisch reseceerbare precursorletsels
Als gevolg van de implementatie van het vlaams bevolkingsonderzoek naar colonkanker (VBO) via fecaal occult bloed testen (iFOBT) worden meer ‘gevorderde’ poliepen of adenomen gedetecteerd (grotere poliepen met of zonder oppervlakkige carcinomateuze ontaarding; Figuur 7) en vroegtijdige carcinomen. Kleine adenomen kunnen meteen tijdens een colonoscopie verwijderd worden met een diathermische lus (klassieke poliepectomie; Figuur 8).
Bij grote colonpoliepen (> 4 cm) is er een grotere kans op ontaarding (tot 20% van deze letsels bevat intramucosale (Tis) of oppervlakkige submucosale (sm1) adenocarcinomen); en-bloc resectie met vrije snijranden geniet hierbij de voorkeur omdat dit de meest betrouwbare informatie levert voor een accurate staging. Piecemeal-EMR dient vermeden te worden omwille van het risico op lokaal recidief of submucosale invasie. Goed gedifferentieerde colorectale letsels met oppervlakkige submucosale invasie (in het colon wordt < 1000 µm submucosale invasie aanvaard) en zonder histologische argumenten voor lymfovasculaire invasie kunnen perfect endoscopisch curatief gereseceerd worden gezien het risico op locoregionale lymfeklieraantasting in die gevallen heel laag is (< 3%). In deze gevallen kan een correct uitgevoerde ESD een radicale operatie vermijden.
Maag
Het is aangetoond dat bij goed gedifferentieerde oppervlakkige tumoren van de maag (intramucosaal of < 500 µm in de submucosa, waarbij het risico op locoregionale lymfeklieraantasting zeer laag is) een en-bloc (R0) resectie correleert met een betere klinische outcome in vergelijking met piecemeal resectie. Dergelijke letsels komen in het Westen relatief zeldzaam voor. Bij H. pylori-infectie kunnen wel soms precursorletsels gedetecteerd worden (dysplastische zones; Figuur 9); deze worden idealiter gereseceerd via ESD wat het risico op lokaal recidief (en eventueel toch evolutie naar ontaarding) zeer klein maakt.
Vroegtijdige neoplasie in Barrett slokdarm
ESD is zeker technisch mogelijk bij focale afwijkingen (hooggradige dysplasie/adenocarcinoma) die ontstaan zijn in Barrett-slijmvlies (Figuur 4b). Grote studies die aantonen dat ESD hier ook een meerwaarde heeft ten opzichte van EMR zijn er op dit moment niet, en dus wordt piecemeal-EMR in deze indicatie soms nog aanvaard. Bij EMR voor grotere letsels kan er twijfel zijn over diepe submucosale infiltratie of onvoldoende informatie betreffende vrije diepe of laterale snijranden waarbij in de meeste gevallen dan toch aanvullende heelkunde (oesophagectomie) voorgesteld zal worden; ESD kan hierbij betere informatie verschaffen (Figuur 6). Endoscopische resectie kan als curatief beschouwd worden indien het een en-bloc R0 resectie betreft van een (maximaal) pT1sm1 letsel (≤ 500 µm) met een laag risicoprofiel (goed tot matig gedifferentieerd zonder lymfovasculaire invasie). Het achterblijvend residueel Barrett- weefsel dient dan behandeld worden met radiofrequente ablatie.
Oppervlakkige spinocellulaire carcinomen van de slokdarm
Deze letsels zijn vaak moeilijk endoscopisch te detecteren (best zichtbaar met specifieke Lugolkleuring met hoge definitie endoscoop; Figuur 10) en worden meestal gezien bij patiënten met een specifiek risicoprofiel (HPV-infectie/roken/synchrone hoofd- en halstumor). Gezien het vaak grote vlakke letsels betreft, biedt ESD hier duidelijk een meerwaarde. Deze tumoren geven sneller lymfekliermetastasen. Endoscopische resectie kan als curatief beschouwd worden indien het een en-bloc R0 resectie betreft van een oppervlakkig mucosaal carcinoma met een laag risicoprofiel (goed gedifferentieerd zonder lymfovasculaire invasie).
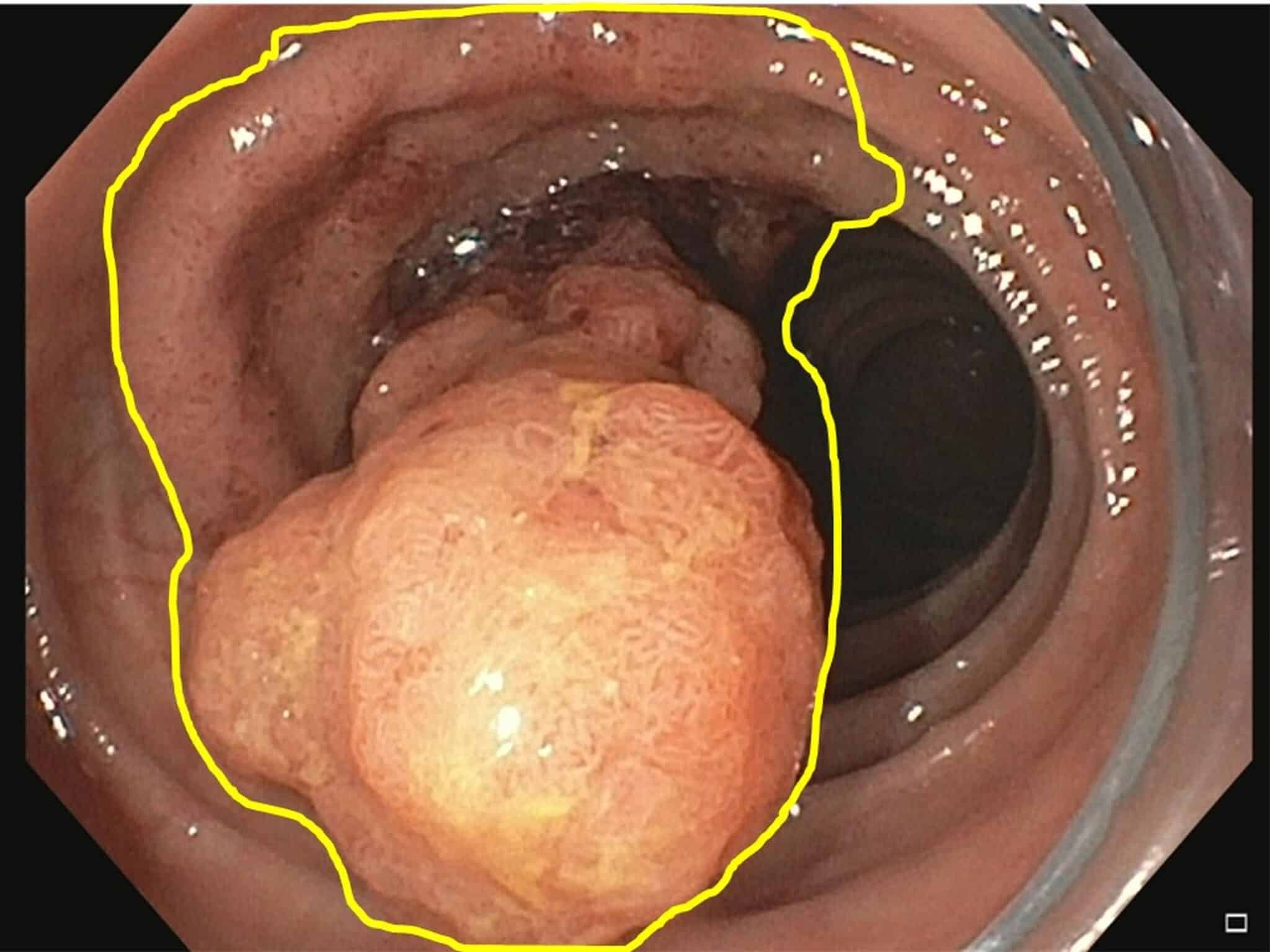
Fig.5a: Grote poliep (geel afgelijnd), tapijtvormig met centraal een grote nodule die verdacht lijkt voor maligne ontaarding.
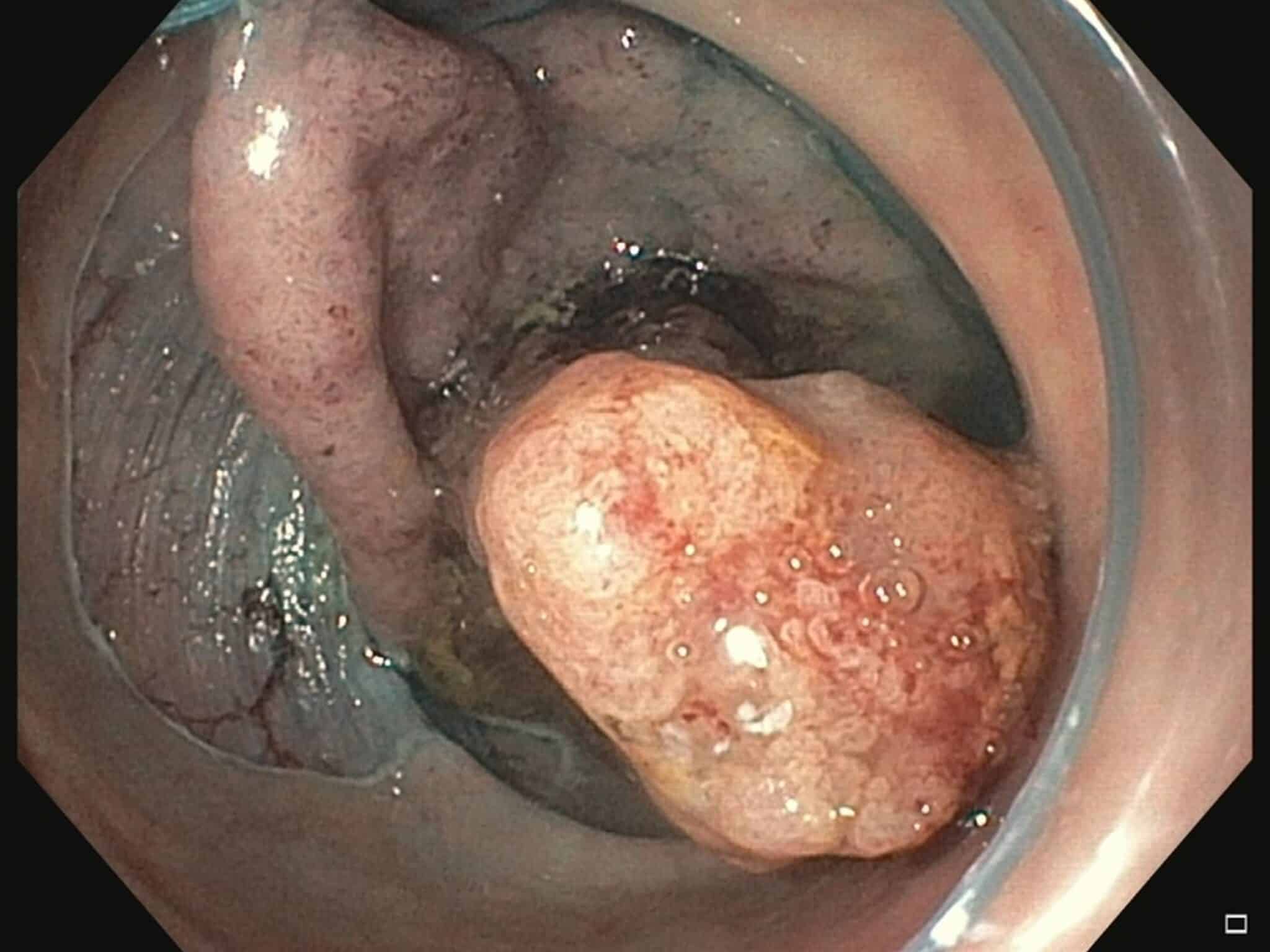
Fig.5b: Mucosale incisie en begin van de dissectie.
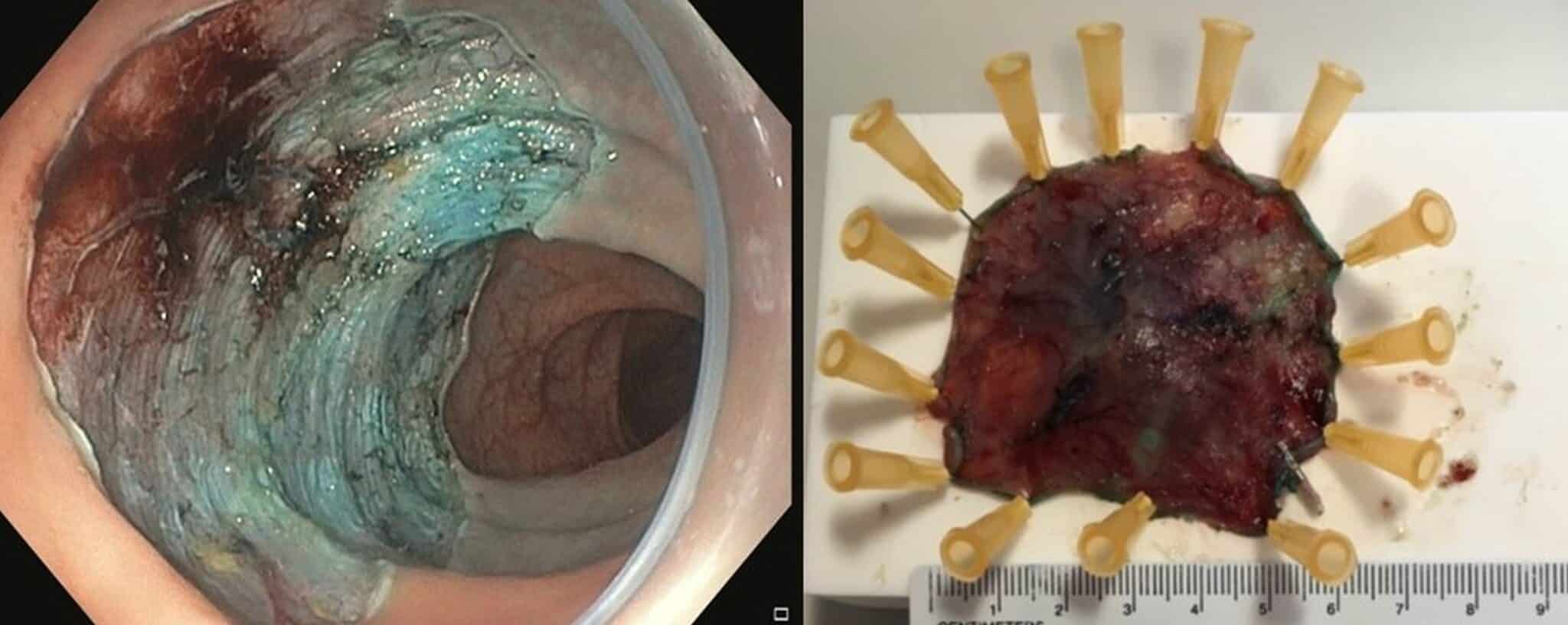
Fig.5c: Status na en-bloc resectie, de poliep wordt omgekeerd opgespeld voor inkting van de diepe snijrand en verder
histologisch onderzoek. Finale diagnose: tubulovilleus adenoma met centrale nodule met intramucosaal carcinoma, ruim verwijderd van de laterale snijrand.
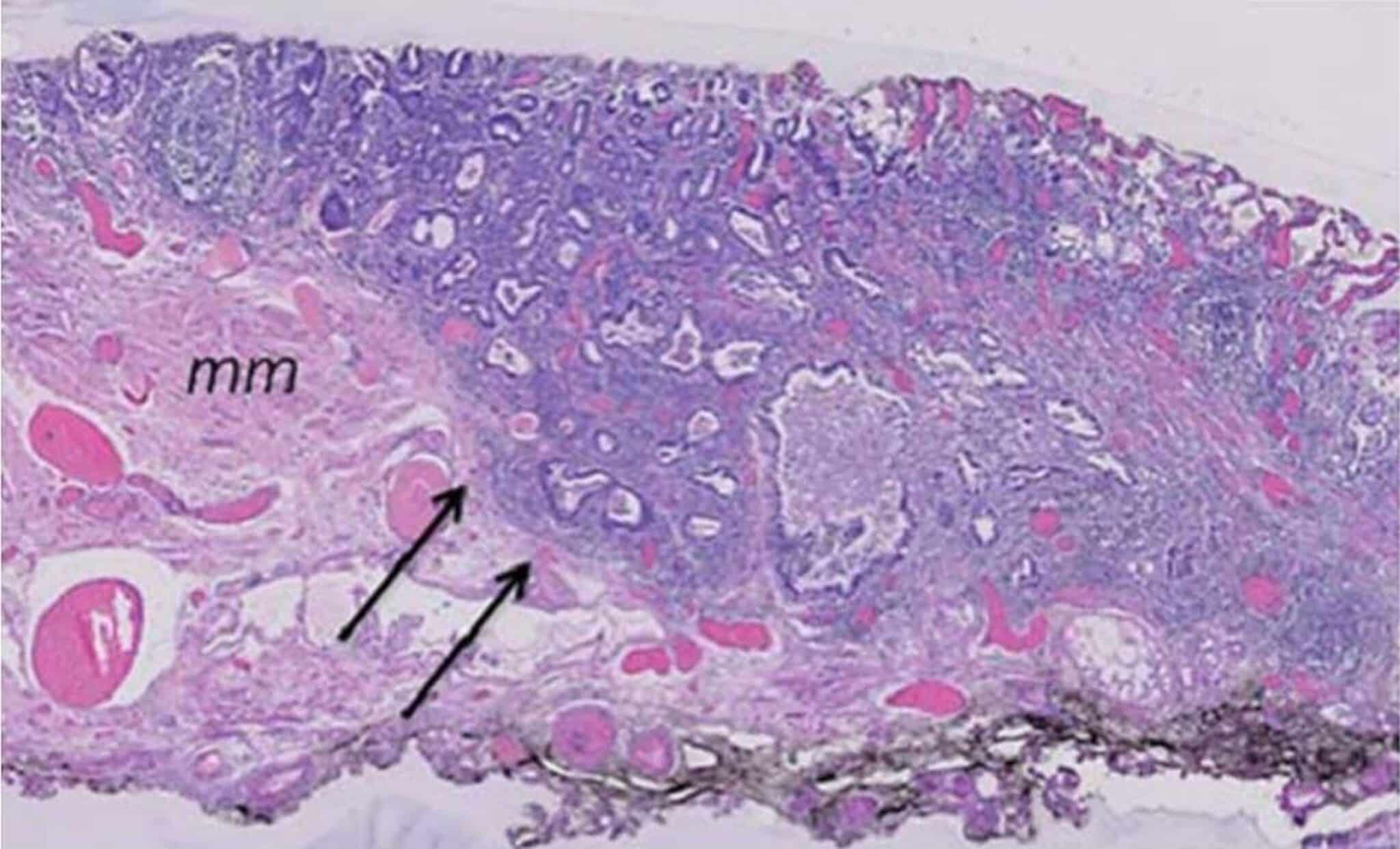
Fig.6: Voorbeeld van een curatieve en-bloc resectie via ESD in een Barrett slokdarm. Histologisch nazicht toont een kleine focus van adenocarcinoma ontstaan in een Barrett slokdarm met beperkte invasie van de submucosa (zwarte pijlen) en met vrije verticale en horizontale marges (staging: pT1sm1; mm: muscularis mucosae).
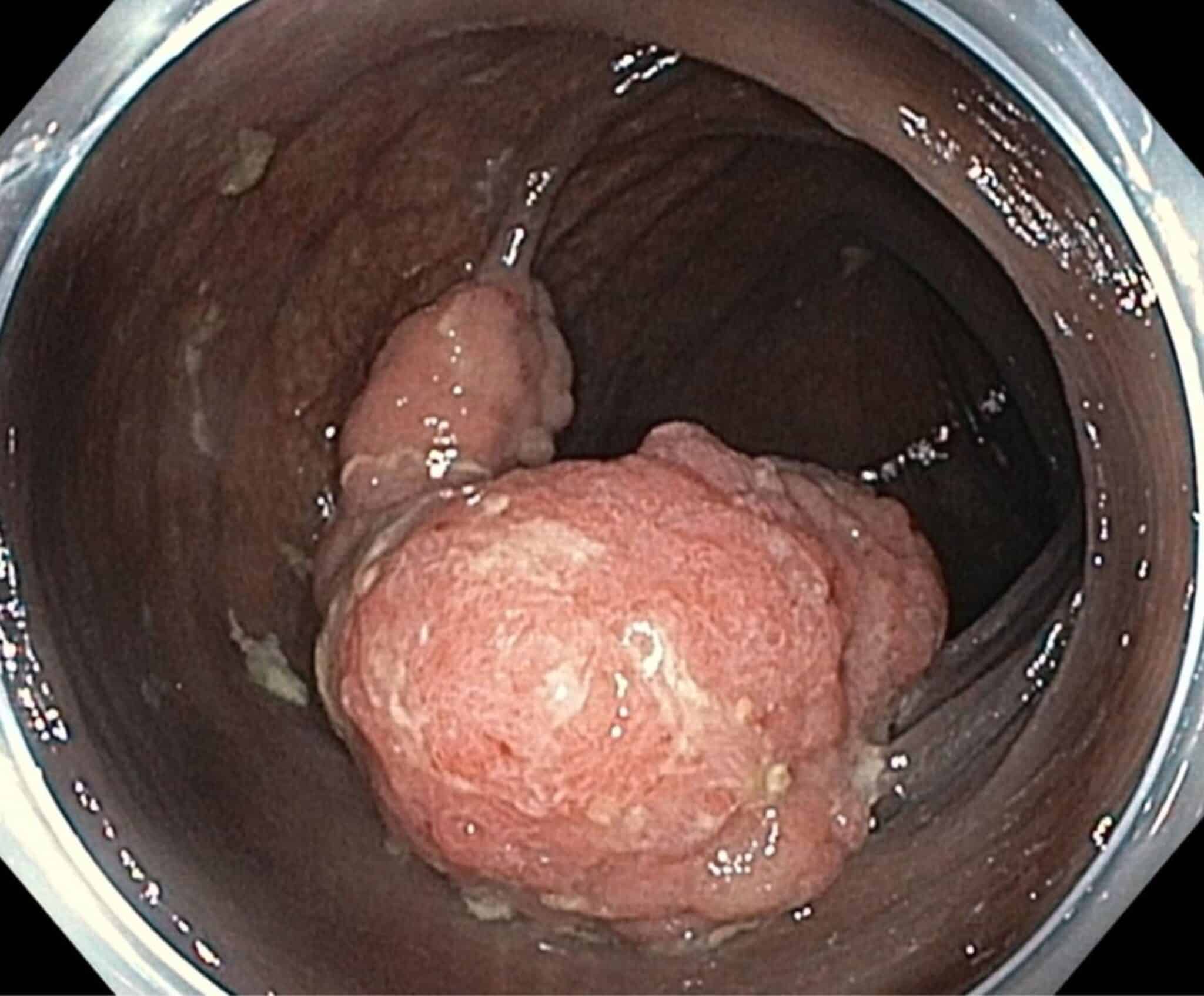
Fig.7: Voorbeeld van een grote gevorderde poliep; gedetecteerd met immunologische fecale occult bloedtest (iFOBT) via het Vlaams Bevolkingsonderzoek.
Na eerdere piecemeal resectie
Bij recidief of residueel poliepweefsel na eerdere piecemeal-EMR kan het zeer moeilijk zijn om deze letsels endoscopisch te reseceren (meestal als gevolg van littekenvorming en fibrose) en dient de patiënt dan toch nog verwezen te worden voor heelkunde. Via ESD kan het toch nog mogelijk zijn om de verschillende lagen in de darmwand te onderscheiden en het letsel vrij te disseceren in de fibrose (Figuur 11).
Submucosale tumoren
Submucosale tumoren die de diepe spierlaag van de darmwand niet invaderen kunnen in principe ook verwijderd worden via ESD en dit zowel in de slokdarm, maag als het colorectum. Dit zijn eerder zeldzame tumoren; de twee meest voorkomende zijn mesenchymale gastro-intestinale stromale tumoren (GIST) en carcinoïde tumoren. Een GIST geeft in principe geen lymfekliermetastasen en is dus een mooie indicatie voor ESD indien het letsel klein (< 3 cm) is en de diepe spierlagen niet invadeert. Verder beleid hangt af van de verdere histologische oppuntstelling (mitose-activiteit). Kleine carcinoïde tumoren (< 1 cm) met lage mitose-activiteit kunnen ook curatief behandeld worden met ESD.
Fig.8: Klassieke poliepectomie (met een diathermische lus) van een kleine poliep.
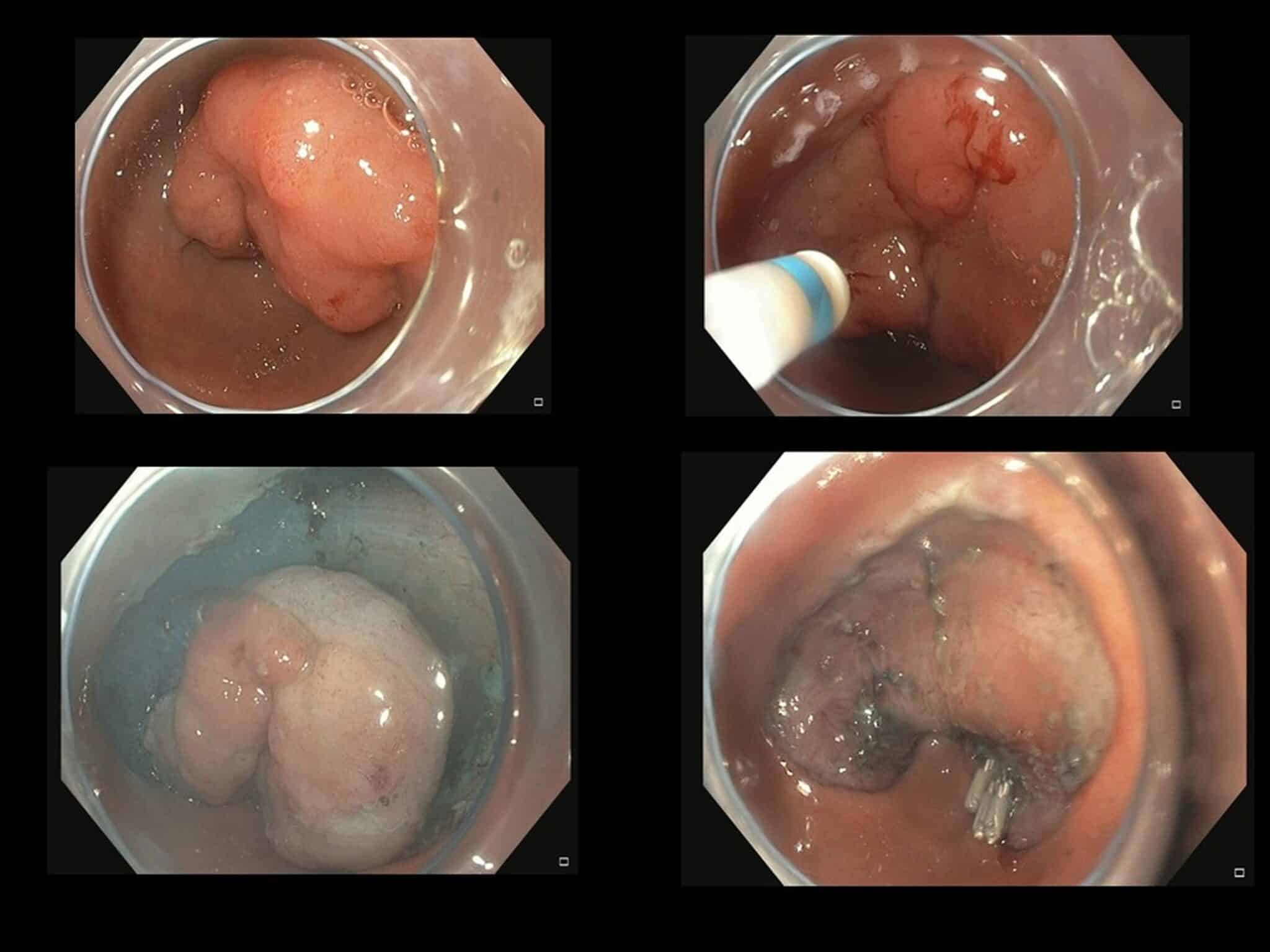
Fig.9: Dysplastisch letsel net boven de pylorus, en-bloc R0 resectie via ESD.
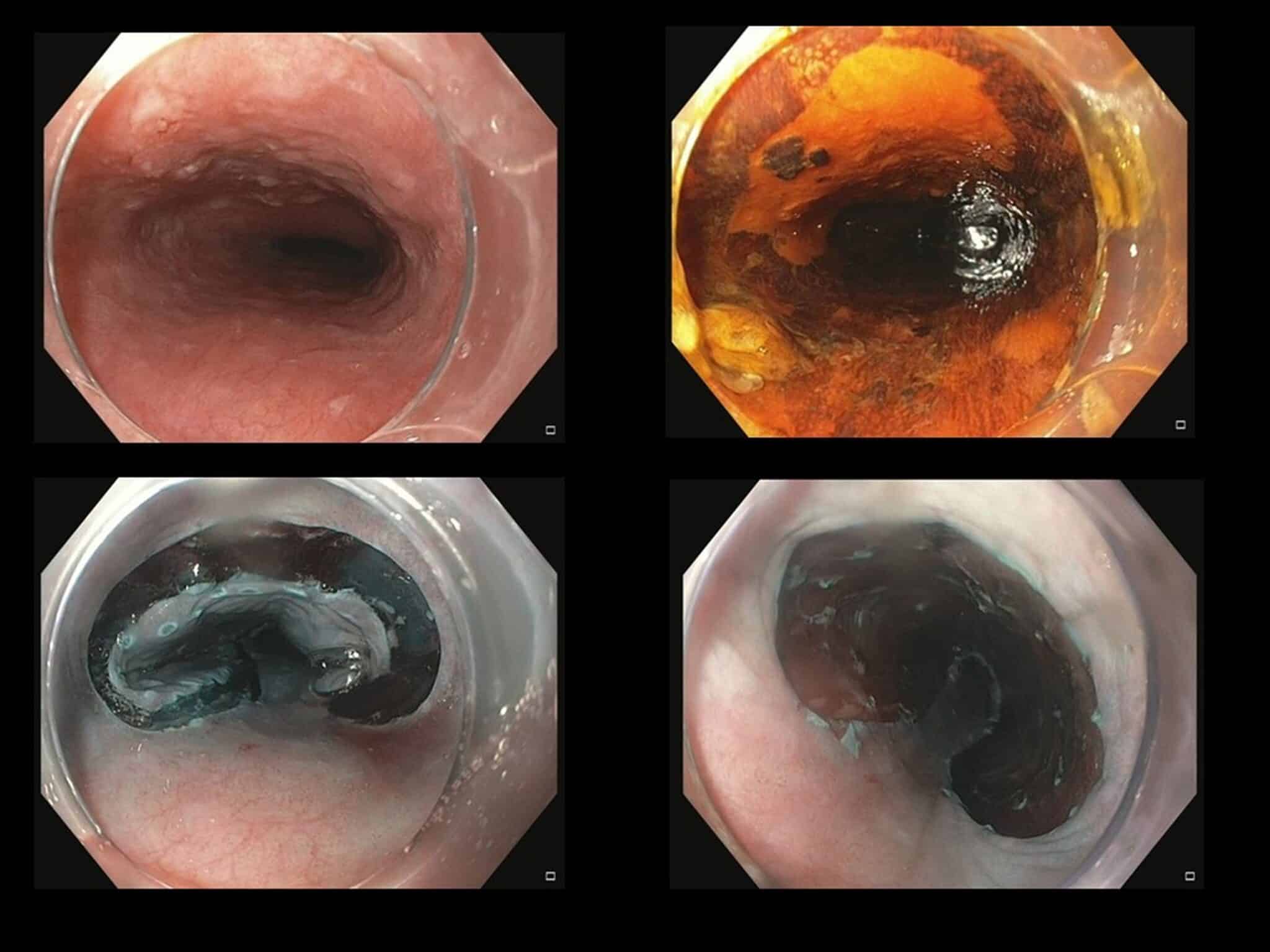
Fig.10: Endoscopisch moeilijk te onderscheiden letsel in de proximale slokdarm. Het eerste endoscopisch beeldje toont een licht verheven moeilijk af te lijnen zone anterieur. Na Lugolkleuring (iodium) zien we een iodo-negatieve zone (gele) zone wat compatibel is met een oppervlakkig spinocellulair carcinoma. Het letsel werd en-bloc verwijderd via ESD; finale staging oppervlakkig mucosaal spinocellulair carcinoma met vrije diepe en laterale snijranden.
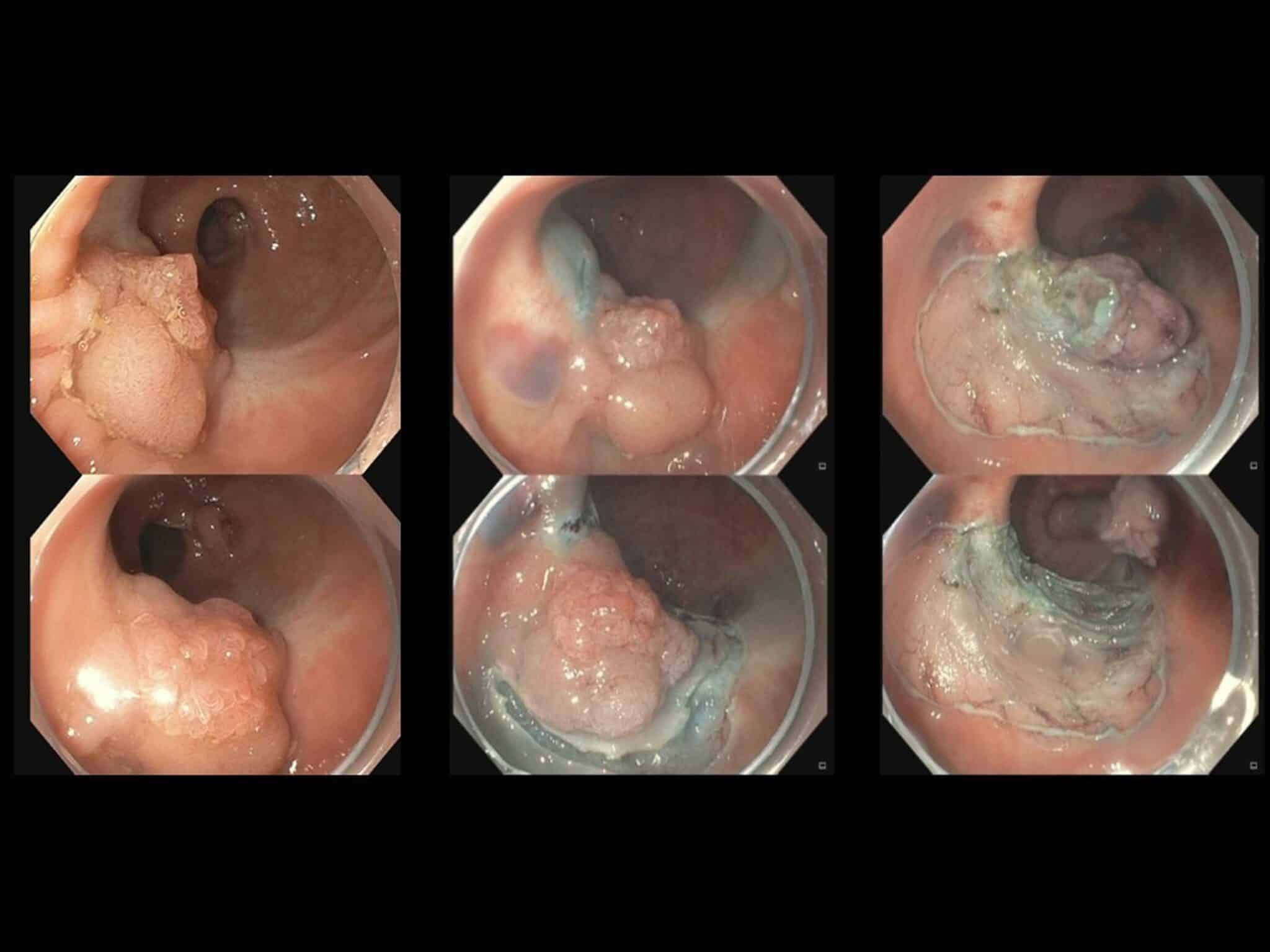
Fig.11: Residueel poliepweefsel in het rectum (witte geretraheerde randen) na eerdere piecemeal-EMR, wat volledig verwijderd kon worden met ESD.
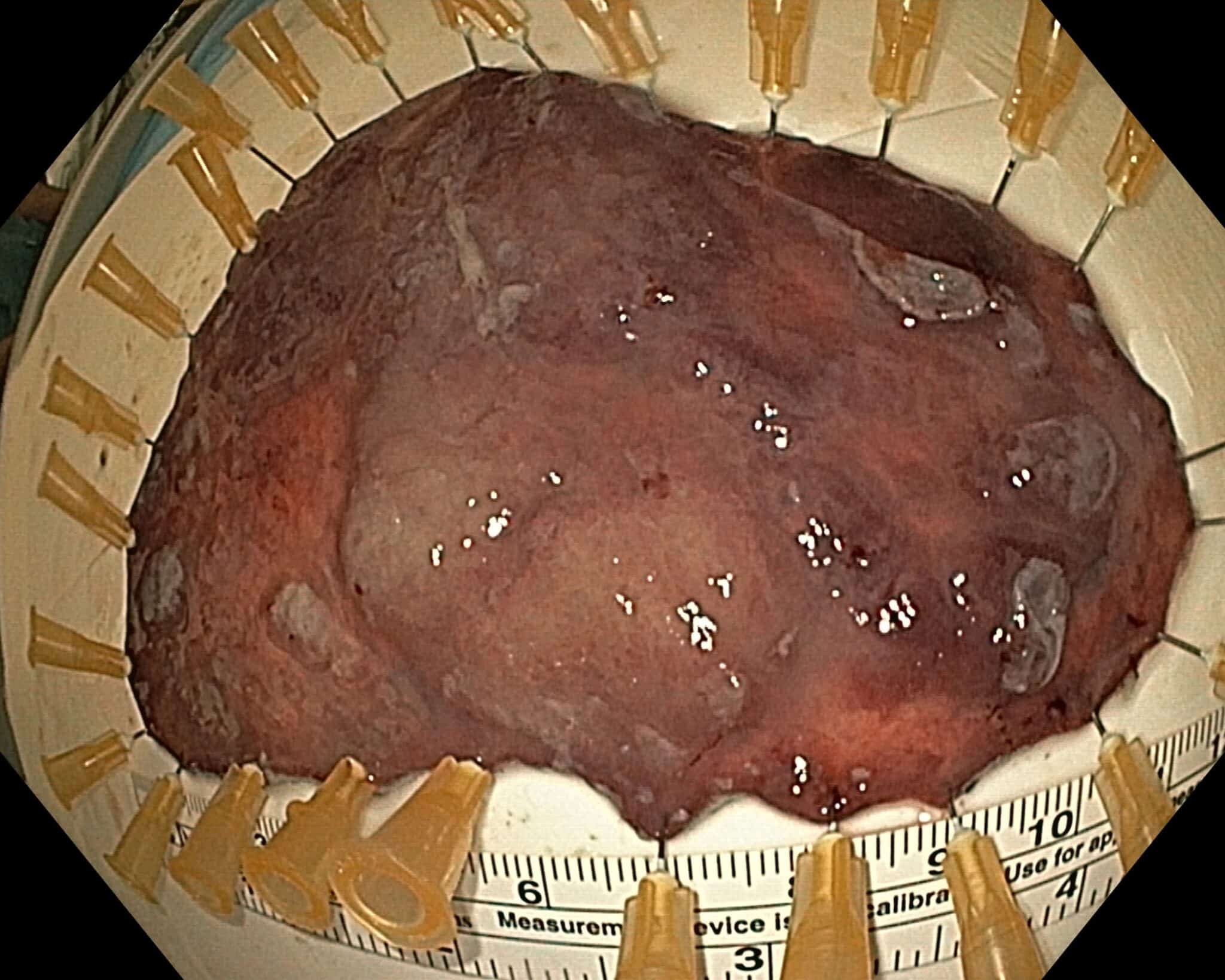
Fig.12: R0 resectie van een 12 cm grote vlakke maagpoliep, finale staging mucosaal adenocarcinoma met vrije diepe en laterale snijranden.
Minder geschikte indicaties voor ESD
In theorie is afmeting geen beperking voor een ESD (Figuur 12). Toch zijn er een aantal gevallen waarbij ESD niet aangewezen of technisch niet mogelijk is.
Het duodenum heeft een erg dunne wand en leent zich daarom niet tot ESD. Duodenale poliepen worden meestal verwijderd via piecemeal-EMR. Enkel in Japan is er beginnende expertise in ESD in het duodenum.
Ter hoogte van scherpe bochten (cardia/fundus van de maag, hepatische/splenische colonhoek) kan het soms onmogelijk zijn om de endoscoop stabiel te positioneren, waardoor het risico op perforatie toeneemt en ESD onmogelijk wordt.
Tenslotte is het logisch dat diep invaderende letsels (diepe spierlaag) niet curatief endoscopisch gereseceerd kunnen worden omdat het risico op lymfeklieraantasting in die gevallen te groot is (behalve bij GIST).
Complicaties
De belangrijkste complicaties zijn strictuurvorming, bloeding en perforatie.
Strictuurvorming is voornamelijk een probleem in de slokdarm wanneer letsels verwijderd worden die >75% van de omtrek innemen. Corticoïden (lokale injectie in het resectie-ulcus of systemisch toegediend) kunnen strictuurvorming reduceren.
Bloeding tijdens de procedure wordt niet als een complicatie beschouwd en kan in principe endoscopisch gestopt worden. Het risico op post-procedure bloedingen is het hoogst bij ESD’s in de bovenste gastro-intestinale tractus en bedraagt ongeveer 5%. Preventieve hemostase met coagulatie en plaatsen van clips kunnen dit risico reduceren.
De meest gevreesde complicatie is een perforatie. De techniek van ESD laat echter toe om de verschillende lagen van de darmwand perfect te onderscheiden en het risico op perforatie is daarom zeer laag (1-5%). De meeste perforaties kunnen tijdens de procedure herkend worden en endoscopisch behandeld.
Specifiek voor ESD’s in het colorectum is ook een ‘post-ESD syndroom’. Dit is meestal het gevolg van excessieve coagulatie waardoor lokale peritoneale prikkeling ontstaat en een systemische inflammatoire respons. Vaak is dit goed te behandelen met antibiotica.
De belangrijkste factor om complicaties te vermijden is ervaring. Deze complexe en tijdrovende techniek met potentieel hoge complicatiegraad in onervaren handen vergt daarom systematische training onder de supervisie van een expert endoscopist in een tertiair hoog-volume centrum. Op dit moment is de ESD-techniek nog niet wijd verspreid buiten de Aziatische (voornamelijk Japanse) expert centra.
Besluit
In Japan is ESD momenteel dé standaardbehandeling voor oppervlakkige tumoren van zowel de slokdarm, maag en colorectum. ESD is in het Westen een relatief nieuwe techniek met een sterk groeiend aantal indicaties. In België bijvoorbeeld, net als in andere Westerse landen, zal het aantal indicaties voor colorectale ESD in de nabije toekomst exponentieel toenemen gezien het grote aantal gedetecteerde vroegtijdige tumoren en/of grote poliepen via het VBO met het gebruik van iFOBT. Op dit moment worden in veel centra dergelijke grote colorectale letsels nog steeds behandeld via piecemeal-EMR of chirurgie. ESD biedt hiervoor een minimaal invasieve techniek met een heel laag risico op recidief (in tegenstelling tot piecemeal-EMR) en kan bij een groot aantal patiënten heelkunde vermijden en de geassocieerde kans op morbiditeit (functionele stoornissen, stoma, …). Ook bij oppervlakkige letsels in de slokdarm en de maag kan ESD invasieve heelkunde vermijden (oesophagectomie/gastrectomie/…). Gezien de noodzaak aan langdurige training (stapsgewijs, beginnende op diermodellen), wordt ESD slechts in een beperkt aantal centra toegepast in België, waaronder sinds november 2015 ook in het AZ Sint-Jan.
Bekijk hier een filmpje aangaande ESD in de maag van een GIST-tumor
U kunt hier het volledige artikel als pdf lezen.