Succesvol invries-dooiprogramma in het Centrum voor Reproductieve Geneeskunde Brugge
Vandaag wordt zonder enige twijfel aanvaard dat het invriezen van reproductieve cellen en embryo’s een noodzakelijke procedure is bij elke vooruitstrevende techniek in het domein van de reproductieve geneeskunde. De routinetoepassing van een goed en veilig invriesprogramma staat immers ontegensprekelijk in relatie met een beter resultaat bij medisch begeleide voortplanting (MBV) en leidt tot hogere cumulatieve zwangerschapscijfers, zowel wat betreft klinische als doorgaande zwangerschappen.
Vitrificatie is het ultrasnel invriezen (-20.000°C/min)
binnen uiterst korte contacttijden (<45 sec) en
met zeer hoge concentraties cryoprotectanten (30%-40%).
Sinds de wetgeving van 2003 worden bij alle vrouwen tot en met 42 jaar die aangesloten zijn bij een Belgische mutualiteit maximum zes in-vitrofertilisatie (IVF) behandelingscycli gefinancierd door de Federale Overheid. In dit kader is het aantal verse embryo’s dat teruggeplaatst mag worden in de baarmoeder wettelijk bepaald volgens de leeftijd van de vrouw en de rangorde van de cyclus. Bij een vrouw van 37 jaar, bijvoorbeeld, mogen in haar tweede verse behandelingscyclus maximum twee embryo’s teruggeplaatst worden; bij een vrouw van 23 jaar in haar eerste behandelingscyclus slechts één embryo.
Het gevolg van deze regelgeving is dat er meer embryo’s overblijven die in deze verse fase niet mogen getransfereerd worden (overtallige embryo’s). Indien hun kwaliteit dit toelaat, worden deze embryo’s (± 30%) ingevroren en bewaard (cryopreservatie). Daarnaast schrijft dezelfde wet voor de ingevroren embryo’s eerst te dooien en terug te plaatsen (Frozen Embryo Transfer of FRET) alvorens een volgende verse cyclus te starten. Op die manier wordt het potentieel van een IVFcyclus om ethische, economische en medische redenen maximaal benut. Dit alles heeft als gevolg dat de cryopreservatie van embryo’s in België zeer belangrijk geworden is.
Cryopreservatie: ideaal ontwikkelingsstadium?
Er bestaat discussie over het ideale tijdstip of ontwikkelingsstadium waarop humane embryo’s worden ingevroren. De hoofdcomplicatie voor delende embryo’s – vanaf dag twee na de inseminatie – is dat een deel van de cellen (of blastomeren) na het ontdooien in het embryo beschadigd kunnen zijn, zodat het implantatievermogen verlaagt van ongeveer 30% naar 10% in vergelijking met volledig intacte embryo’s. Voor verder ontwikkelde embryo’s (blastocysten, op dag 5 na de inseminatie) blijkt celverlies na het ontdooien minder nefast voor de verdere ontwikkeling, omdat de cellen kleiner en talrijker aanwezig zijn. De meest evolutieve blastocysten zijn met hun groeiende of expanderende holte echter zeer gevoelig voor koelingsschade en overleven de conventionele ontdooiprocedures in minder dan 40% van de gevallen.
Traag invriezen versus vitrificatie
De eerste humane delende embryo’s werden succesvol ingevroren in 1983 (Trounson en Mohr). In 1985 werden blastocysten ingevroren door Cohen. Beiden gebruikten een trage invriesmethode. Deze techniek beperkt het risico op celschade door intracellulaire ijskristalvorming: het delicate evenwicht tussen de traag dalende temperatuur (-0,3°C/min) en de cellulaire dehydratatie wordt ondersteund door een 10% koude beschermende stof (cryoprotectant) en een suikergroep (bv. propaandiol of dimethylsulfoxide (DMSO) met sucrose).
In 2001 startte Mukaida met een ultrasnelle invriestechniek op blastocysten met een positieve klinische uitkomst bij de mens: vitrificatie of letterlijk verglazing van embryo’s. Vitrificatie is het ultrasnel invriezen (-20.000°C/min) binnen uiterst korte contacttijden (<45 sec) en met zeer hoge concentraties cryoprotectanten (30%-40%). Door de extreem hoge viscositeit van het medium wordt onmiddellijk een vaste fase bereikt zonder vorming van ijskristallen.
Zo wordt de ijskristalbeschadiging omzeild en is de blootstelling aan toxische en osmotische schade door de cryoprotectanten beperkt in de tijd. Voor deze techniek zijn speciale houders ontwikkeld die toelaten met minimale volumes tot 1 microliter (µl) cryoprotectant te werken, en die (in)direct contact kunnen maken met vloeibare stikstof (-196 °C). Figuur 1 toont de verschillen tussen traag invriezen en vitrificatie.
Invriestechnieken en innovatie
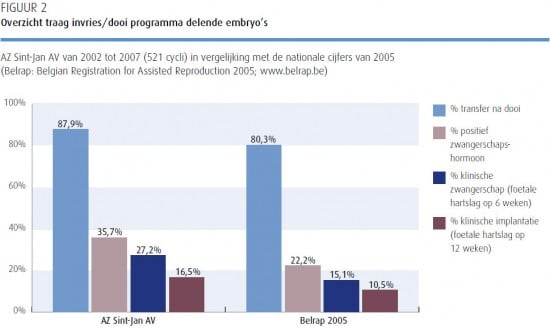
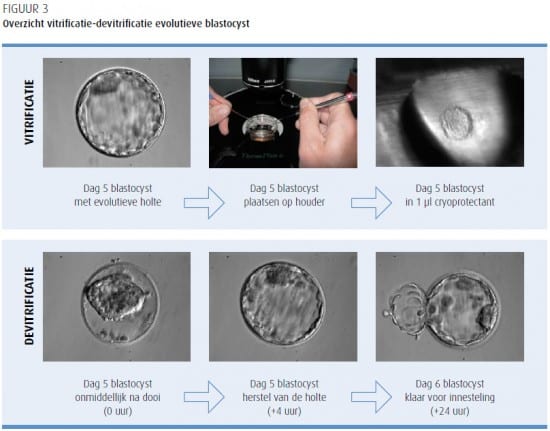
Vandaag is de trage invriesmethode voor delende embryo’s en blastocysten wereldwijd de meest gebruikte methode. In 2000 was AZ Sint-Jan AV het eerste Belgische ziekenhuis dat de trage invriesmethode voor delende embryo’s succesvol toepaste in een veilig, volledig gesloten bewaarsysteem. Met dezelfde voorzichtigheid en rekening houdend met de geldende veiligheid- en kwaliteitsnormen werd de vitrificatietechniek geïntroduceerd voor blastocysten (figuur 2 en 3).
Vitrificatie zal in 2009 uitgebreid worden voor eicellen, die uiterst gevoelig zijn aan vriesschade. De techniek zal toegepast worden voor acute eicelpreservatie wanneer geen beschikbare zaadcellen voorradig zijn na een eicelaspiratie of als optie vóór therapie bij vrouwelijke oncologische patiënten.
In de nabije toekomst zal de vitrificatietechniek toegepast worden voor het invriezen en bewaren van donoreicellen, zodat dezelfde serologische veiligheid geboden wordt, zoals nu bij spermadonatie. Ten slotte blijkt vitrificatie succesvol voor ovariumweefsel. Uit de diermodellen en de eerste humane klinische studies blijkt de vitrificatiemethode voor cellen en weefsels echter verschillend te zijn. De uitdaging voor optimale vitrificatieresultaten is dus de techniek per cel- of per weefseltype fijner af te stellen. De vitrificatie is aan een opmars begonnen om een wereldwijde revolutie te ontketenen in het toekomstige cryopreservatiebeleid van reproductieve cellen en weefsels.
Conclusie
Vitrificatie is een veilige methode voor het invriezen van humane embryo’s. Wanneer de kwaliteit van een delend embryo dit toelaat, laten we dit embryo in de laboratoriumomgeving verder ontwikkelen. Het terugplaatsen in de baarmoeder van een mooi ontwikkelde en leefbare blastocyst resulteert immers in hogere zwangerschaps- en implantatiekansen (resp. ± 50% en ±35%). De blastocyst is dan ook het eerste biologisch materiaal dat vandaag routinematig wordt gevitrificeerd in het laboratorium CRG van AZ Sint-Jan AV. In vergelijking met de trage invriesmethode verdubbelen de overlevingskansen na het dooien tot meer dan 80%.
Referenties
1. Cohen J, Simons Rf, Edwards Rg et al.
Pregnancies following the frozen storage of expandinghuman blastocysts. Journal of In Vitro fertilization and Embryo Transfer 1985;2:59-64.
2. Mukaida T, Nakamura S, Tomiyama T,Wada S, Kasai M.,Takahashi K
Successful birth after transfer of vitrified human blastocysts with use of a cryoloop containerless technique. fertil. Steril.
2001;76:618-620.
3. Trounson A, Mohr L. Human pregnancy following cryopreservation, thawing and transfer of an eight-cell embryo. Nature 1983;305:707-709.