Acute luchtweginfectie is het meest wijdverspreide type van acute infectie bij kinderen en volwassenen, en een significante oorzaak van ziekte bij immuungecompromitteerde patiënten. In 2002 waren respiratoire infecties verantwoordelijk voor 18% van de mortaliteit wereldwijd bij kinderen onder vijf jaar; diarree (15%) en malaria (11%) vormden de twee daaropvolgende belangrijkste oorzaken. Respiratoire infecties lokken niet enkel een toename van mortaliteit uit, maar veroorzaken eveneens een verhoogde morbiditeit in deze leeftijdsklasse: tussen 22% (UK) en 26,7% (België) van alle pediatrische hospitalisaties en tussen 33,5% (Italië) en 59% (UK) van huisartsconsulten gebeuren naar aanleiding van een respiratoire virale infectie. Deze infecties treden op met een hogere frequentie in het jonge leven ten opzichte van het volwassen leven, met gemiddeld vijf tot zes infecties per jaar.
Symptomen en virologisch onderzoek
Preanalytische fase van moleculaire biologie: de laborant brengt het potentieel infectieus respiratoire staal over in de testbuisjes. Daarna gebeurt een automatische extractie van de aanwezige nucleïnezuren uit het klinisch monster, en vervolgens de amplificatie van viraal/bacterieel RNA en/of DNA.
De meeste respiratoire virusinfecties in de vroege kindertijd blijven beperkt tot de bovenste luchtwegen en geven aanleiding tot een verkoudheid met neusloop, hoest en heesheid. Bij fysisch onderzoek van de patiënt merkt de arts rhinitis en pharyngitis, vaak geassocieerd met conjunctivale ontsteking of otitis media. Bovenste luchtweginfecties (URTI of Upper Respiratory Tract Infection) gaan in het algemeen gepaard met koorts, lethargie en povere voedingsinname. Ongeveer een derde van de kinderen die een infectie doormaken met een respiratoir virus ontwikkelen lage luchtwegsymptomen zoals tachypneu, wheezing, een uitgesproken hoest, kortademigheid en ademhalingsproblemen.
Extrapulmonale manifestaties van lage luchtweginfecties (LRTI of Lower Respiratory Tract Infection) die o.a. voor RSV (Respiratoir Syncytiaal Virus)infecties beschreven zijn, worden zelden geobserveerd. Ze omvatten stuipen, hyponatriëmie, cardiale aritmie, hartfalen en hepatitis. Erg interessant is dat het viraal RNA niet enkel ter hoogte van de respiratoire tractus wordt gedetecteerd, waar het epitheel de primaire site van infectie en virale replicatie is, maar dat het ook transiënt terug te vinden is in mononucleaire cellen in perifeer bloed en, zeer sporadisch, in cerebrospinaal vocht en cardiale spieren, wat op zich het vermoeden doet rijzen van occasionele extrapulmonale verspreiding.
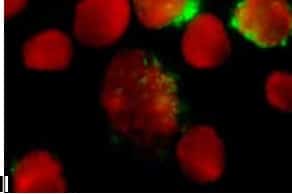
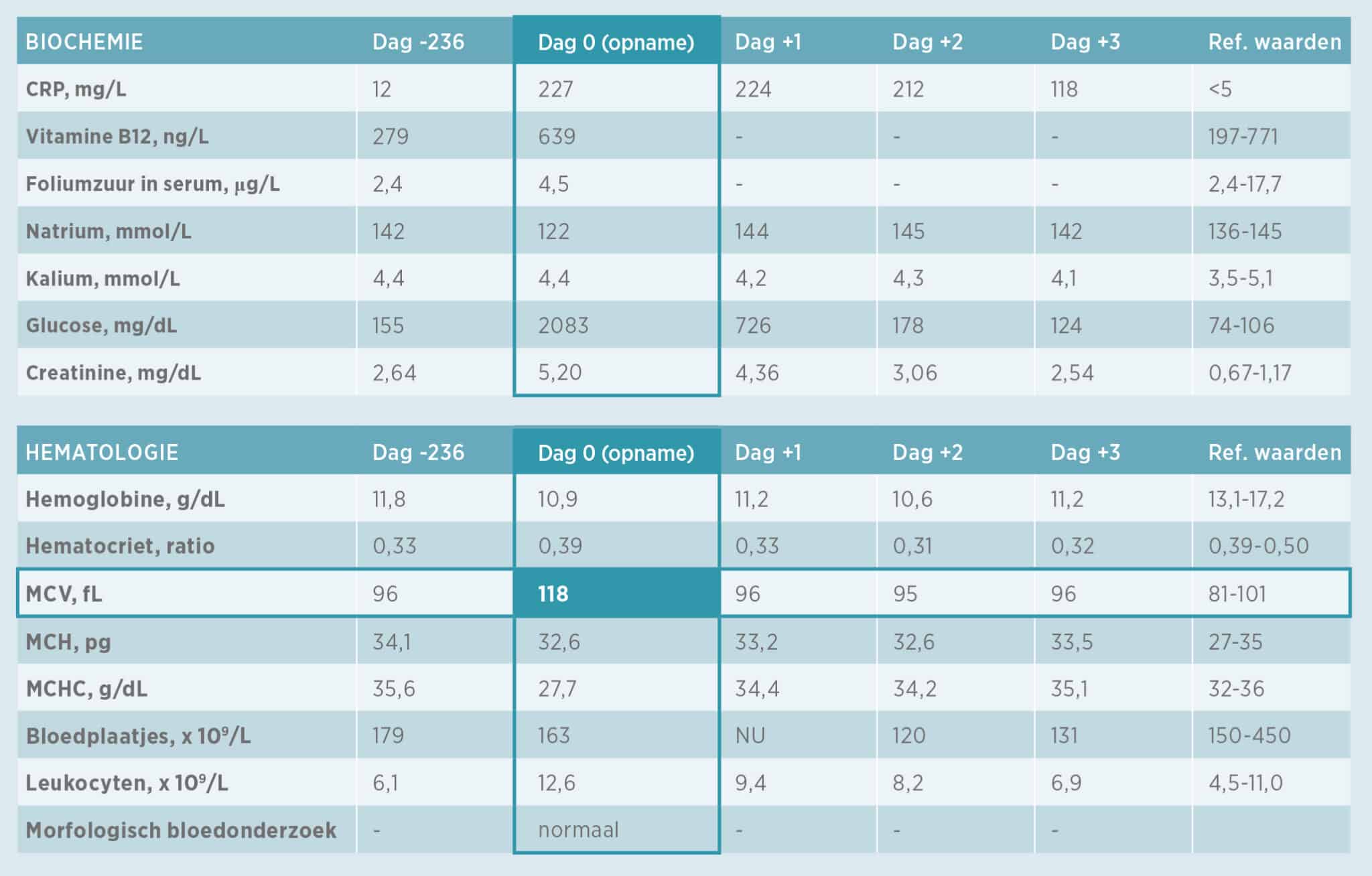
Epitheliale syncytiumvorming in longalveoli als gevolg van een RSV-infectie.
Tijdens de pandemische golf van influenza A(H1N1)v2009 troffen onderzoekers in uitgesproken mate viraal RNA aan in serum additioneel aan respiratoire specimens, maar eveneens in stoelgang en urine, wat belangrijk is bij het nemen van infectiecontrolemaatregelen. In zeer uitzonderlijke gevallen kon eveneens viraal RNA gedetecteerd worden in cerebrospinaal vocht bij patiënten met een ziektebeeld van encephalitis.
Neurologische verwikkelingen, inclusief convulsies, encephalitis, encephalopathie, het syndroom van Reye en andere neurologische aandoeningen, werden reeds beschreven in associatie met – of net volgend op – een luchtweginfectie waarbij griepvirussen (influenza A of B) aan de basis lagen. In het algemeen, bij kinderen die symptomen van influenza-like ilness (ILI) vertonen, gepaard met onverklaarbare convulsies of acute veranderingen in de mentale status, kan de clinicus een “respiratoire” pathogeen (influenza, enterovirus, parechovirus, RSV, Mycoplasma pneumoniae) in overweging nemen in zijn differentiaaldiagnose.
Een consequente en systematische screening van respiratoire monsters met behulp van efficiënte moleculaire detectietechnieken biedt dan ook een grote meerwaarde voor de einddiagnose. De rationale hiervan ligt vooral in het feit dat virussen in een veel hogere concentratie terug te vinden zijn in respiratoire stalen dan in lumbaalvocht, en bovendien gedurende minstens drie weken na het verschijnen van de symptomen detecteerbaar blijven via PCR (Polymerase Chain Reaction). Bij fragiele patiënten of patiënten met een hoog risico op complicaties, waar de toestand erg kritisch is, dient prompt een empirische antivirale therapie gestart te worden indien beschikbaar. Gelukkig breidt het arsenaal antivirale middelen, naast de bestaande middelen gebruikt voor influenza en RSV, zich traag maar zeker verder uit.
Verhoogd risico op jonge leeftijd
De waarschijnlijkheid van infectie is afhankelijk van twee factoren: de leeftijd en de blootstelling aan een infectieus agens. Eens een infectie optreedt, wordt de ernst ervan bepaald door zowel omgevingsfactoren als genetische risicofactoren. Jonge leeftijd ageert als een metafactor die een beeld geeft van de interactie tussen alle andere factoren die een rol spelen in het veroorzaken van ziekte na een virale infectie. De leeftijd beïnvloedt uiteraard de afmetingen van het kind, in het bijzonder die van de luchtwegen, evenals de transmissie dynamica (als gevolg van de veelvuldige nauwe contacten tussen jonge kinderen) en de immuunrespons, die bij kinderen kritisch verschilt van die van volwassenen. Daarenboven hebben jonge kinderen kleinere energiereserves en geraken ze sneller uitgeput door ademhalingsinspanningen, de ultieme oorzaak van mortaliteit in acute bronchiolitis.
Voor kinderen met een LRTI die ambulant worden gevolgd, stelt de arts vaak geen virale diagnose. De meeste respiratoire virussen kunnen LRTI veroorzaken van erg uiteenlopende ernst en met een brede waaier van symptomen, en voor het merendeel zijn geen klinisch bruikbare antivirale middelen beschikbaar. Hoe dan ook is de detectie van een virale oorzaak van LRTI zeer nuttig gezien deze het gebruik van antibiotica – niet absoluut vereist in de meeste gevallen van virale LRTI – kan reduceren. Voor kinderen die het risico lopen op ernstige LRTI (o.a. prematuriteit, congenitale hartziekte) is een vroege virale diagnostiek cruciaal. Een aantal virussen (predominant RSV) kunnen immers aanleiding geven tot een ernstige infectie die strikte monitoring vereist en, in geval van klinische achteruitgang, vroegtijdige hospitalisatie. Bij 1 à 2% van de kinderen zal een LRTI tot hospitalisatie leiden. Voor deze kinderen is een virale diagnostiek bij opname cruciaal voor een efficiënte isolatie van de patiëntjes, om zo nosocomiale infectie te vermijden. Bovendien is bij kinderen en immuungedeprimeerde patiënten een bijkomstig probleem aanwezig van significant verlengde virale excretie (shedding).
Virale etiologie en hospitalisatie
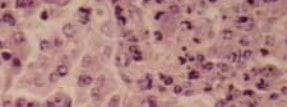
Electronmicroscopische opname van
adenoviruspartikels.
Een onderlinge vergelijking van verschillende virussen als oorzaak van infectie levert meer inzicht in de ziekteverschijnselen die volgen op een respiratoire infectie, en bezorgt ons eveneens relevante data voor het uitwerken van preventiestrategieën. Er is steeds meer evidentie dat respiratoire virussen in staat zijn om een persisterende infectie te veroorzaken. Maar het werkelijk belang van persistentie, en of nu de gastheer dan wel het virus zelf de doorslaggevende rol speelt, is onduidelijk. Een persisterende infectie kan een grote viruspool voorzien voor reïnfecties, of er blijft een pool van viraal antigeen en/of genomisch materiaal achter die een adaptief immuungeheugen onderhoudt. Virussen hebben zich zo ontwikkeld dat ze het immuunsysteem mijden, en deze ontwijking is kritisch voor de virale gastheerspecificiteit, met een enorme impact op de gastheerrespons na infectie.
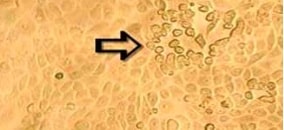
Groei van hMPV op LLC-MK2-cellen
(continue cellijn met “epithelial-like” groei, afkomstig van de nieren van rhesusaapjes) na vijf dagen incubatie, met zichtbaar cytopathogeen effect en destructie van het celtapijt
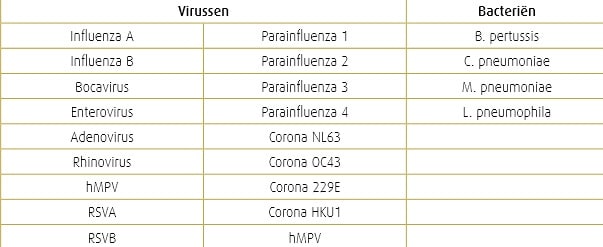
De combinatie van virale immuunsuppressie en de beperkte immuunrespons kenmerkend voor een jonge leeftijd zal de hoeveelheid van virusgemedieerde schade vergroten, en dus de ziekte verergeren. Wanneer bijvoorbeeld een rhinovirus of adenovirus gedetecteerd wordt tijdens een RSV-infectie, ziet men geen toename in de ernst van de ziekte; de co-infectie met zowel hMPV als RSV daarentegen verhoogt het aantal opnames op intensieve zorgen.De volgende virussen detecteert men regelmatig tijdens acute respiratoire infecties: adenovirus (actueel 56 serotypes, ingedeeld in groep A-G), coronavirus (OC43, NL63, 229E, HKU1), enterovirus, humaan metapneumovirus (hMPV A en B), influenzavirus A-B-C, parainfluenzavirus 1-4 (PIV), rhinovirus (RV type A-B-C), parechovirus (type 1-16), polyomavirussen KI en WU, bocavirus en natuurlijk RSV A en B. We kunnen een aantal brede besluiten trekken omtrent virale etiologie enkinderhospitalisatie naar aanleiding van een respiratoire infectie:
- Het influenzavirus, adenovirus, hMPV, PIV, RV en RSV kunnen allen bronchiolitis (en zeldzaam pneumonie) veroorzaken die hospitalisatie vereisen.
- Bij kinderen is RSV veruit de belangrijkste oorzaak van hospitalisatie als gevolg van bronchiolitis en verhoogde ziekte-ernst.
- Virale co-infectie is een frequent voorkomend fenomeen dat optreedt in circa 20 à 25% van de gevallen. Er is geen consensus betreffende het effect van co-infectie op de ernst van ziekte, en het hangt zeker af van welke virussen betrokken zijn bij de co-infectie.
Het relatieve belang van de individuele virale agentia in het jonge leven staat ter discussie. In de gepubliceerde literatuur zijn RSV, RV, PIV en influenza predominant aanwezig. Maar er zijn verschillende factoren die een definitieve en juiste besluitvorming omtrent welk virus nu het meest voorkomend of klinisch het belangrijkst is, erg limiteren:
- de manier van datacollectie (PCR versus immunoassay) tussen studies en binnen eenzelfde studie
- de impact van analytische gevoeligheid
- de variaties in studiedesign, met name de leeftijd en de inclusiecriteria, en welke virussen bestudeerd worden
- de opsplitsing van de jaren in verschillende seizoenen terwijl sommige virussen een jaarlijks terugkerende piek kennen en anderen heel het jaar door prevalent zijn
- de “oneerlijke” vergelijking in vroegere studies tussen virussen op het vlak van hun in vitro aanwezigheid (meer specifiek het gemak van in vitro RSV-detectie in vergelijking met bv. moeizame klassieke diagnose van rhinovirussen)
- de doorslaggevende veranderingen volgend op de introductie van reverse-transcriptase-PCR voor RNA-virussen
- de PCR-diagnose van een virus, die niet noodzakelijk wijst op het ziekmakend vermogen van dat virus (er is evidentie van viraal RNA in asymptomatische kinderen en eveneens evidentie van virale persistentie)
- het overwicht van ziekenhuisgebaseerde studies die focussen op meer ernstige ziekte
Diagnosetechnieken
Er zijn vier manieren om respiratoire virussen te diagnosticeren: virale kweek, serologie, immunofluorescentie/antigeendetectie en nucleinezuur/PCR-gebaseerde testen. Bij viruskweek komt het erop neer om klinische respiratoire monsters te enten op verscheidene cellijnen en zo, bij replicatie van het virus in de cellen, het cytopathogeen effect van het aanwezige virus te bestuderen. Bij serologie wordt bloed onderzocht op de aanwezigheid van virusspecifieke antistoffen of, minder frequent, van viraal antigeen, d.m.v. een functionele test. Het nadeel van beide technieken is dat ze arbeidsintensief zijn en laattijdig resultaten opleveren (een klassieke virale kweek kan 10 tot 14 dagen duren, en de antilichaamrespons na virale infectie heeft vaak twee weken nodig alvorens meetbaar te worden). Bijgevolg is de infectie reeds onder controle of zijn de symptomen verdwenen alvorens het infectieus agens gedefinieerd is. Het routinematig gebruik van deze twee technieken is niet langer van toepassing in een diagnostische setting, maar kan een rol spelen in epidemiologisch onderzoek en wanneer het verloop van een infectie van nabij dient opgevolgd te worden.

op aanwezigheid van een co-infectie met meerdere pathogenen.
Antigeendetectie is gebaseerd op het gebruik van virusspecifieke monoklonale antilichamen voor een snelle virale detectie rechtstreeks op het monster. Er is een enorme waaier aan diagnostische virale sneltesten op de markt, met erg uiteenlopende en seizoensgebonden specificiteiten en gevoeligheden (gaande van 31% voor detectie van influenza A/H1N1v2009 d.m.v. immunochromatografie op nasofaryngale wissers van volwassenen, tot 98% voor de directe immunofluorescentie van RSV op aspiraten van neonaten). Idealiter voert het labo antigeendetectie enkel uit op nasofaryngale aspiraten, nasofaryngale wissers of nasal wash specimens. Het viraal antigeen wordt gedetecteerd d.m.v. een geconjugeerd enzyme (Enzyme ImmunoAssays of EIA) of immunofluorescentie. Hoewel deze testen nog wijdverspreid beschikbaar zijn, laten ze zich stilaan vervangen door nucleïnezuurdetectietesten omwille van hun hogere gevoeligheid en specificiteit, en het feit dat ze minder afhankelijk zijn van preanalytische factoren (condities van transport en bewaring van klinische monsters) en de manier van staalname (hoeveelste dag na start van ziekteverschijnselen, staaltype, recipiënt, leeftijd van patiënt).
Infectueuze oorzaken van bronchiolitis
Vanaf het huidige winterseizoen zullen we in het AZ Sint-Jan Brugge-Oostende AV, campus Sint-Jan, in welbepaalde indicaties voor de speurtocht naar respiratoire virussen een moleculaire detectie (“multiplex”-PCR) hanteren. Hierbij kunnen achttien virale targets en vier atypische bacteriën gelijktijdig worden opgespoord rechtstreeks op respiratoire monsters, na een ligatie-PCR (co-amplificatie) gevolgd door een smeltcurveanalyse van het amplificatieproduct. De gevalideerde staaltypes omvatten BAL (Broncho-Alveolair Lavagevocht), nasofaryngale aspiraten, nasofaryngale en keelwissers (enkel “flocked” swabs in universeel transportmilieu) en nasale spoelingen. Deze monsters dienen zo snel mogelijk naar het labo getransporteerd te worden, zoniet moet men ze bewaren bij 4°C gedurende maximum 48 uur. De analyse zal tijdens de wintermaanden twee- à driemaal per week gebeuren, in functie van het aantal stalen. Bij hoogdringendheid kan men nog steeds rekenen op een snelle antigeendetectietest voor influenza A/B, RSV, PIV1-3, adenovirus en hMPV (met zijn beperkingen weliswaar).
Wanneer is deze “multiplex”-PCR aangewezen?
- bij patiënten op intensieve zorgen, waar bacteriële kweken negatief blijven en respiratoire symptomen met een duidelijk afwijkende beeldvorming maar zonder gekende etiologie aanwezig zijn
- bij immuundepressie, meer bepaald uitgesproken lymfopenie (hemato-oncopatiënten, HIV-patiënten, chronisch gebruik van systemische immunosuppressiva,…) gezien daar de sneltesten vaker vals negatief zijn, en het belang van para-influenza, hMPV en adeno zeer goed gekend en beschreven is, naast de gekende soms dramatische gevolgen van RSV en influenzavirussen
- bij kinderen tussen 0 en 5 jaar waar de virale pathogenen in de sneltest negatief blijken, maar de respiratoire symptomen hospitalisatie vereisten
- in een aantal specifieke klinische indicaties, zoals atypische pneumonie en laryngotracheïtis (vaak associatie met para-influenza 3, bocavirus, rhinovirussen of Bordetella pertussis), waar er weinig tot geen alternatieve technieken zijn voor detectie van het etiologisch agens in de acute fase van infectie.
Het aantal causale agentia van acute RTI is groot en erg divers, wat een enorme diagnostische uitdaging inhoudt. De co-amplificatie van verschillende targets zal ons inzicht versterken in de klinische betekenis van gemengde infecties en eveneens in de prognose van de verschillende virale infecties.
Referenties
1 To KK, Chan KH, Li IW, Tsang TY, Tse H, Chan JF, Hung IF, Lai ST, Leung CW, Kwan YW, Lau YL, Ng TK, Cheng VC, Peiris JS, Yuen KY. 2010. Viral load in patients infected with pandemic H1N1 2009 influenza A virus. J Med Virol. 82(1):1-7.
2 Centers for Disease Control and Prevention (CDC). 2009. Neurologic complications associated with novel influenza A (H1N1) virus infection
in children – Dallas, Texas, May 2009. MMWR Morb Mortal Wkly Rep. 58(28):773-8.
3 Aberle JH, Aberle SW, Pracher E, Hutter HP, Kundi M, Popow-Kraup T. 2005. Single versus dual respiratory virus infections in hospitalized infants: impact on clinical course of disease and interferon-gamma response. Pediatr. Infect. Dis. J. 24:605-610.