Namens de leden van het Beroertezorgnetwerk Noord-West-Vlaanderen: dr. Sofie De Blauwe, dr. Danny Decoo, prof. Luc Defreyne, dr. Yvette Geerts, dr. Johan Ghekiere, dr. Joost Kager, dr. Penka Kirilova, dr. Jen Maes, dr. Annelies Terwecoren, dr. Peter Vanacker, dr. Carine Vandycke, dr. Geert Vanhooren & dr. Marie-Damienne Verhalle
De mechanische trombectomie is ongetwijfeld de grootste vooruitgang sinds de komst van de intraveneuze trombolyse halfweg de jaren 90. Ze zal het therapeutische beleid bij acute beroerte voorgoed wijzigen. Dit nieuwe tijdperk in de behandeling van acute ischemische beroerte kondigde zich aan met de recente publicatie van de positieve resultaten van enkele grote gerandomiseerde studies (MR CLEAN[1], EXTEND-IA[2], ESCAPE[3], SWIFT PRIME[4] en REVASCAT[5]). De therapie kan toegepast worden bij 4 à 5% van de ischemische beroertepatiënten.
Acute beroerte
Een beroerte, ook wel cerebrovasculair accident genoemd, manifesteert zich als een herseninfarct (80%) of als een hersenbloeding (20%). Een herseninfarct ontstaat wanneer er in een deel van de hersenen onvoldoende bloedvoorziening is door verstopping vaneen bloedvat. Aderverkalking of een bloedklonter kunnen deze verstopping veroorzaken. We spreken van een hersenbloeding wanneer er een ruptuur optreedt in een bloedvat.
In de westerse wereld is beroerte de derde belangrijkste doodsoorzaak. Meer dan 5 miljoen mensen sterven jaarlijks aan de gevolgen ervan. Een beroerte gaat niet alleen gepaard met een hoge graad van mortaliteit, het is bovendien de voornaamste oorzaak van langdurige invaliditeit. Niet minder dan 30 miljoen mensen leven dagelijks met de gevolgen van een cerebrovasculair accident. In België zijn jaarlijks meer dan 20.000 mensen het slachtoffer van een beroerte. Globaal gezien zal op drie patiënten één overlijden, één levenslang zorgbehoevend zijn en één (zo goed als) volledig herstellen. Naast de dramatische gevolgen voor de patiënt en zijn directe omgeving is er ook een belangrijke socio-economische impact. De kost voor hospitalisatie, behandeling en revalidatie bedraagt gemiddeld 45.000 euro per patiënt per jaar in België.
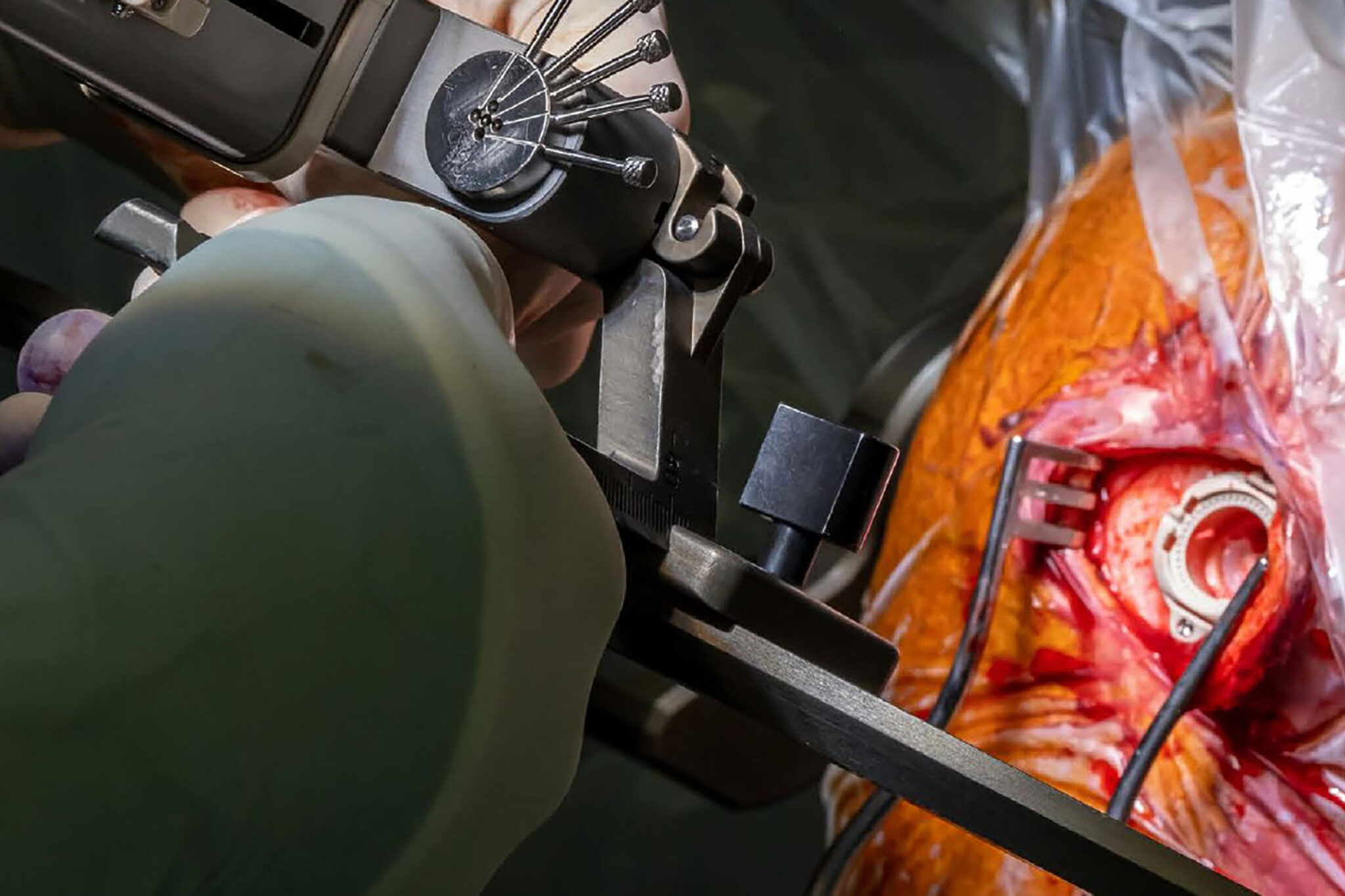
Figuur 1: Bloedklonters worden geëxtraheerd met behulp van een kleine stent
Actueel zorgpad
Regionale en supraregionale beroertezorgnetwerken groeperen de zorgcentra die voldoen aan alle voorwaarden voor een erkenning in acute beroertezorg en faciliteren onderlinge doorverwijzing in geval van een specifieke indicatie.
Omdat de eerste uren na een beroerte cruciaal zijn, is het zeer belangrijk de symptomen op tijd te herkennen, snel te reageren en meteen door te verwijzen naar de dichtstbijzijnde beroertezorgeenheid. Zodra de patiënt in het ziekenhuis aankomt, start het beroerteteam een diagnostische procedure met een klinische evaluatie (NIHSS-score – National Institutes of Health Stroke Scale), bloedafname en onmiddellijke CT-scan, ter uitsluiting van een hersenbloeding.
In geval van ischemie en als er geen contra-indicaties zijn (o.a. recente bloeding, heelkunde of trauma, hartinfarct, epileptisch insult, snelle volledige recuperatie – bv. Bij een voorbijgaande ischemische aanval,…) wordt een intraveneuze trombolyse met rtPA (recombinant weefselplasminogeenactivator) gestart, idealiter terwijl de patiënt zich nog op de CT-tafel bevindt, tot maximaal 4,5 uur na het ontstaan van de beroerte. De intraveneuze trombolyse blijft een stevig gevalideerde standaardbehandeling voor acute ischemische beroerte in elk ziekenhuis van het beroertezorgnetwerk.
Figuur 2a: Deze CT-scan van de hersenen toont een bloedklonter (gele pij l) proximaal in de mediale tak.
Figuur 2b: Deze klonter zorgt voor occlusie van het hersenbloedvat (in dit voorbeeld de arteria carotis interna).
Figuur 2c: Na klonterextractie is de doorgankelijkheid van het bloedvat hersteld.
Therapeutische doorbraak
In de klinische praktij k zien we dat de medicamenteuze trombolyse in geoptimaliseerde omstandigheden bij slechts 15% van de beroertes toegepast kan worden: heel vaak presenteren de patiënten zich niet binnen het tij dsvenster van 4,5 uur of zij n er contra-indicaties voor een intraveneuze trombolyse. De respons van een proximale bloedklonter op de intraveneuze trombolyse is daarenboven meestal zeer beperkt[6], zeker indien de klonter langer is dan 8 mm[7].
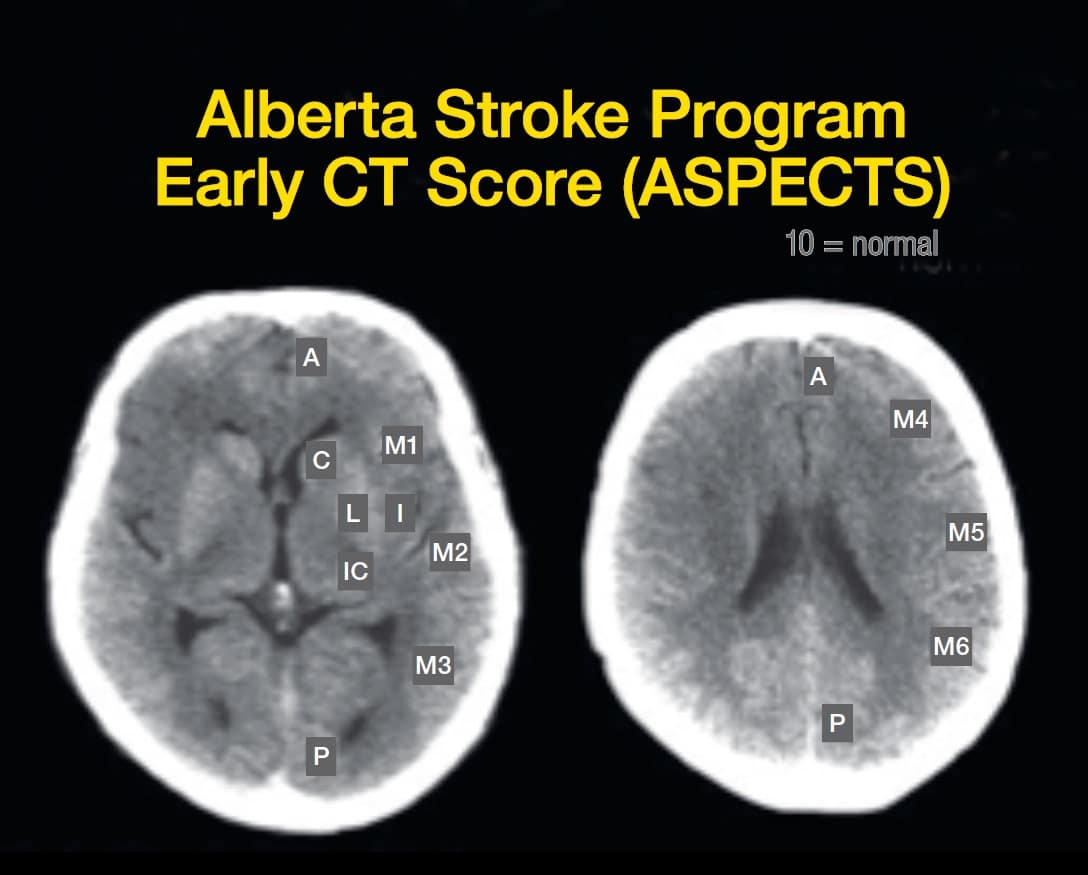
Bij 4 à 5% van de ischemische beroertepatiënten is een goede outcome enkel haalbaar na een mechanische, snelle rekanalisatie van het geoccludeerde bloedvat (zie figuur 2c).[8] Sinds kort kan deze mechanische trombectomie op een wetenschapelij k gevalideerde manier gebeuren met een procedure waarbij de interventionele (neuro)radioloog een stent (zie figuur 1) gebruikt die hij via een bloedvat in de lies opvoert tot op het niveau van de klonter. Het moet gaan om een proximale klonter (zie figuren 2a en 2b) waarbij de CT-scan nauwelij ks of geen ischemische parenchymalteraties vertoont (zie figuur 3: ASPECT score >7). De trombus wordt samen met de stent verwij derd door een combinatie van aspiratie en extractie.
Daar waar een louter medicamenteuze trombolyse een rekanalisatie bereikt bij hooguit 45% van de patiënten, is dit door een mechanische trombectomie mogelij k bij 80% van de gevallen. De behandeling kan effi ciënt en veilig uitgevoerd worden tot 6 uur na de eerste tekenen van een beroerte in de voorste circulatie (carotis) en tot 12 uur in de posterieure (vertebrobasilaire) circulatie. Het globaal risico is vergelijkbaar met dat bij een intraveneuze trombolyse.
Figuur 3: De ischemie-score wordt bepaald op basis van een CT-scan van de hersenen.
Bridging protocol
Een trombectomie lij kt volgens de publicaties het best te werken in combinatie met een intraveneuze trombolyse. Eens de intraveneuze trombolyse opgestart is, gaat de patiënt – indien deze beantwoordt aan de juiste criteria – onmiddellij k van de CT-scan naar de angiozaal voor de mechanische trombectomie. Het voordeel van deze onmiddellij k gecombineerde behandeling is dat er geen extra tij d verloren gaat met het wachten op een eventuele lytische respons, dat de klonter vlotter meekomt en dat klonterfragmenten die eventueel loskomen bij de klonterextractie (en aldus met de bloedstroom naar distaal toe migreren) ook opgelost kunnen worden.
Over het algemeen volstaat een CT-scan zonder contrasttoediening om de bloedklonter aan te tonen en de graad van ischemie te beoordelen. In geval van discordantie tussen klinische en radiologische bevindingen wordt – na het desgevallend opstarten van de medicamenteuze trombolyse – een CT-angiografie uitgevoerd. Een CT-perfusie kan in moeilij ke casussen een meerwaarde betekenen, maar wordt gewoonlij k niet in de beslissingen betrokken. Magnetische resonantie (NMR) kan nuttig zij n in die gevallen waar het begintij dstip van de symptomen niet gekend is, zoals bij een wake-up stroke. Specifi eke NMR-sequenties (DWI-FLAIR mismatch) kunnen aanwij zingen geven of de patiënt alsnog in aanmerking komt voor therapie.
Logistiek
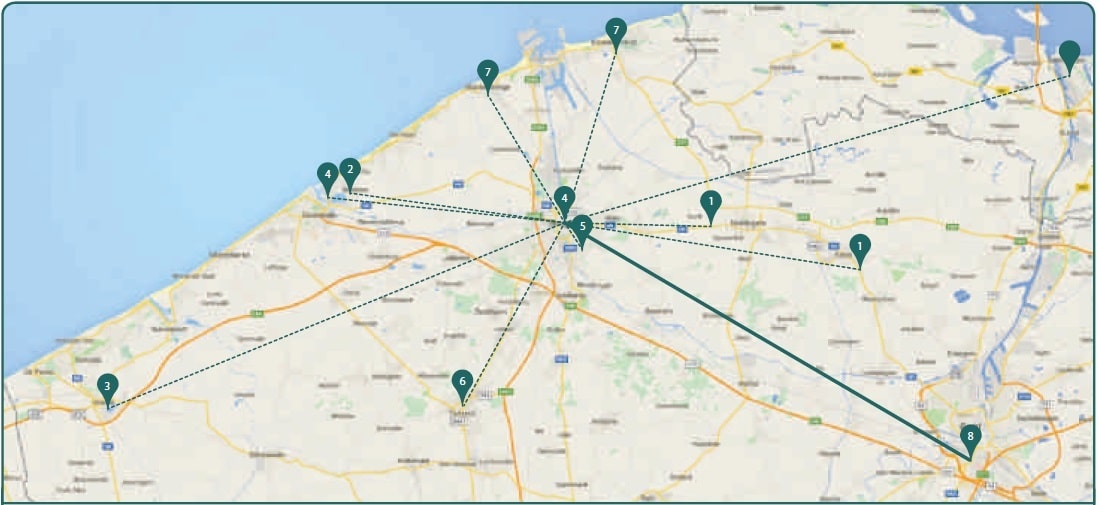
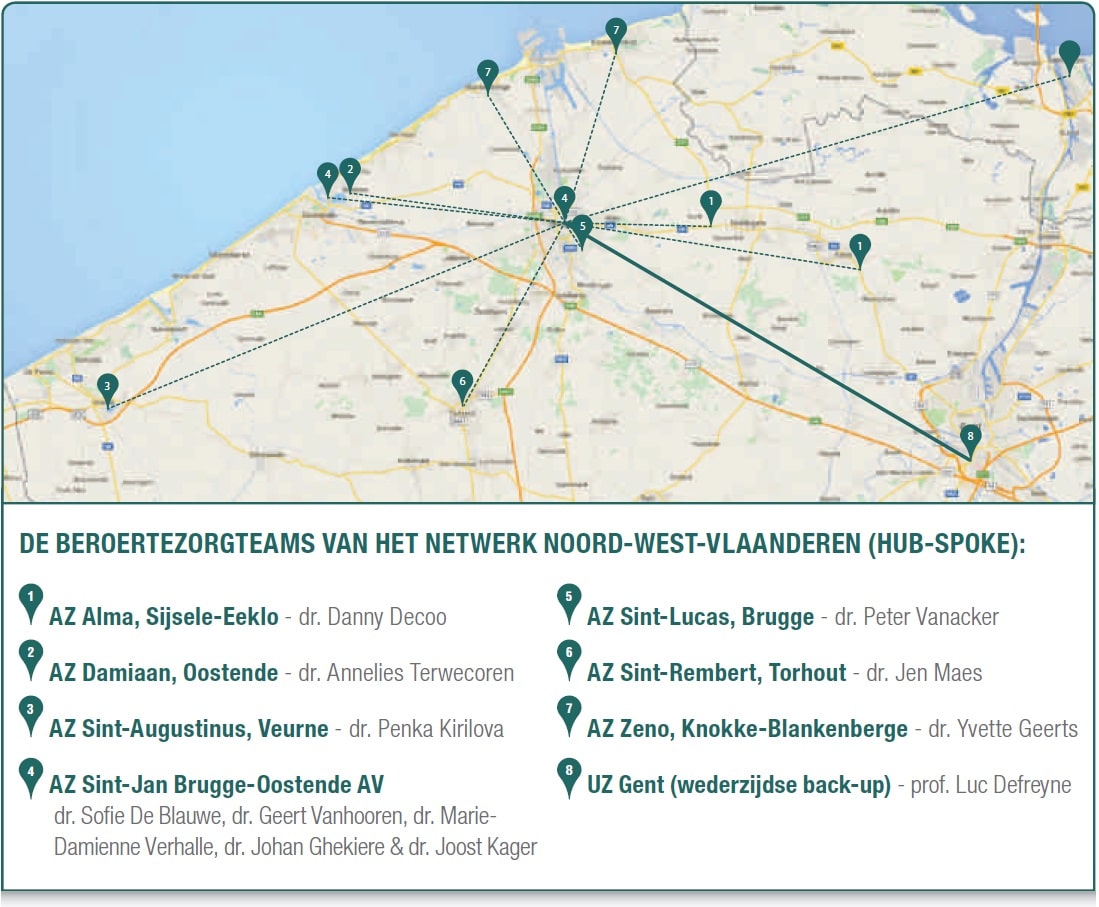
Een intra-arteriële behandeling van het acute herseninfarct stelt zware eisen aan de logistiek binnen het ziekenhuis. Een neuro-interventieteam, bestaande uit een interventioneel neuroradioloog, radiologisch laborant, neuroloog (met expertise in de acute beroertebehandeling) en anesthesist, moet continu beschikbaar zijn. Deze logistiek voor het uitvoeren van een trombectomie wordt in het AZ Sint-Jan Brugge-Oostende AV gedeeld binnen het huidige netwerk van deelnemende ziekenhuizen volgens een ‘hub-spoke’ model waarbij hoogtechnologische zorg vanuit de ‘spokes’ naar de ‘hub’ wordt gecentraliseerd (zie figuur 4). Naast de deelnemende ziekenhuizen worden ook vanuit het Zeeuwse drainagegebied van de ziekenhuisgroep Zorg-Saam (Terneuzen) patiënten in Brugge behandeld. Na de opstart van een intraveneuze trombolyse in een van de individuele ziekenhuizen wordt in overleg binnen het netwerk een indicatie gesteld voor de trombectomie. Die kleine groep, op dit ogenblik ongeveer 4 à 5% van alle ischemische beroertepatiënten, wordt vervolgens dringend voor de trombectomie getransfereerd. De coördinatie van het gehele beroertetraject, lokaal en binnen het netwerk, is in handen van de neuroloog.
Figuur 4
Eerste resultaten in het AZ Sint-Jan Brugge-Oostende AV
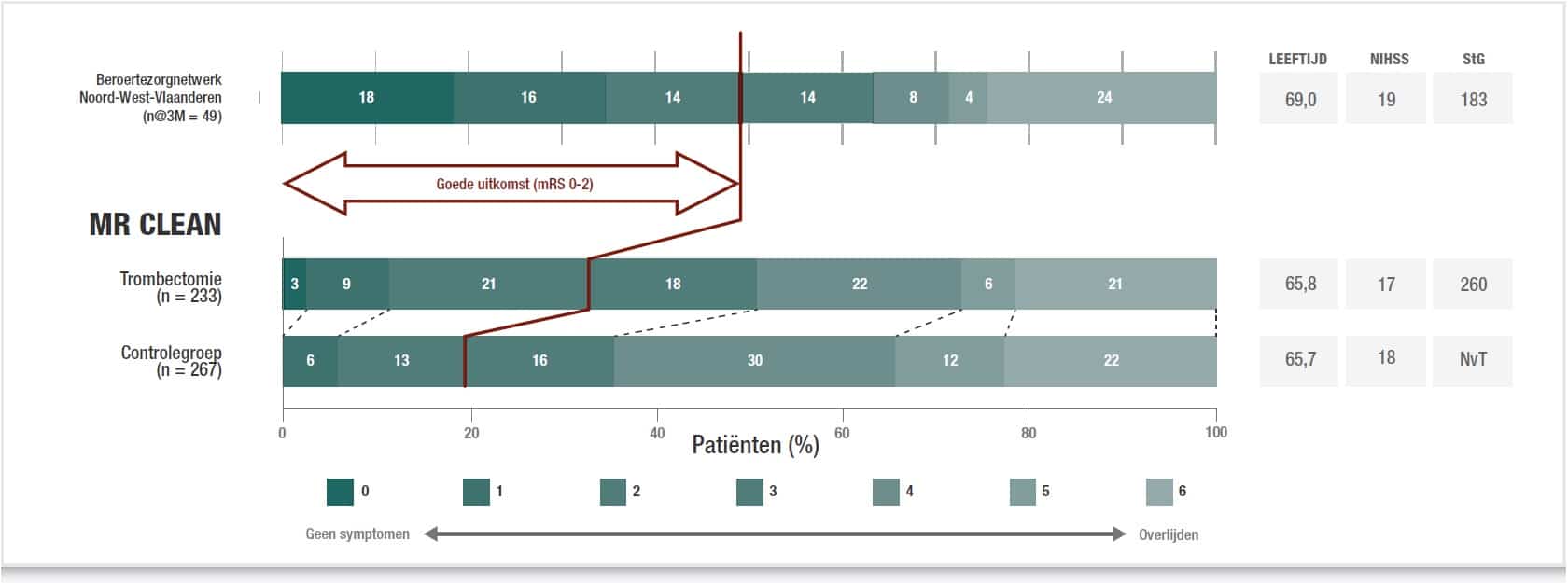
Van de 66 behandelde patienten tot op vandaag zijn er 49 klinisch gescoord op dag 90. Een mRS-score (modified Rankin Scale) van 0 staat gelijk aan een volledig herstel, een mRS-waarde van 6 staat gelijk aan een overlijden. Klassiek wordt een mRS-waarde tussen 0 en 2 beschouwd als een goede uitkomst. Dit wordt uitgedrukt in een Grotta-plot die de functionele uitkomst weergeeft (zie figuur 5).
Figuur 5: Deze Grotta-plot toont, van de 66 met trombectomie behandelde patiënten, de functionele uitkomst (mRS-score) van de 49 patiënten waarbij een evaluatie drie maanden na de beroerte beschikbaar is. De tabel duidt op de vergelijkbaarheid van de verschillende groepen, meer bepaald voor twee prognostisch belangrijke baseline parameters. De StG (tijd tussen de beroerte en de liesprik voor de trombectomie in minuten) is binnen het netwerk 80 minuten korter. Dit verklaart mede de betere uitkomst, aangezien er theoretisch voor elke 30 minuten tijdswinst een betere uitkomst te verwachten valt bij 10% extra patiënten.
Referenties
1. Berkhemer, O., et al, for the MR CLEAN Investigators (2015). A Randomized Trial of Intraarterial Treatment for Acute Ischemic Stroke. New England Journal of Medicine, January, 372(1), 11-20.
2. Campbell, B., et al, for the EXTEND-IA Investigators (2015). Endovascular Therapy for Ischemic Stroke with Perfusion-Imaging Selection. New England Journal of Medicine, Epub February 11.
3. Goyal, M., et al, for the ESCAPE Trial Investigators (2015). Randomized Assessment of Rapid Endovascular Treatment of Ischemic Stroke. New England Journal of Medicine, Epub February 11.
4. Saver, J., et al, for the SWIFT PRIME Investigators (2015). Stent-Retriever Thrombectomy after Intravenous t-PA vs. T-PA Alone in Stroke. New England Journal of Medicine, Epub April 17.
5. Jovin, T., et al, for the REVASCAT Trial Investigators (2015). Thrombectomy within 8 Hours after Symptom Onset in Ischemic Stroke. New England Journal of Medicine, Epub April 17.
6. Sillanpää, N., Saarinen, J., Rusanen, H., Elovaara, I., Dastidar, P., Soimakallio, S. (2013). Location of the clot and outcome of perfusion defects in acute anterior circulation stroke treated with intravenous thrombolysis. American Journal of Neuroradiology, January, 34(1), 100-106.
7. Riedel, C., Zimmermann, P., Jensen-Kondering, U., Stingele, R., Deuschl, G., Jansen, O. (2011). The importance of size: successful recanalization by intravenous thrombolysis in acute anterior stroke depends on thrombus length. Stroke, June, 42(6), 1775-1777.
8. Rha, J., Saver, J. (2007). The impact of recanalization on ischemic stroke outcome, a meta-analysis. Stroke, 38 (3), 967-973.
Download het artikel als PDF-bestand.
Copyright © 2015 AZ Sint-Jan Brugge-Oostende AV. Alle rechten voorbehouden. De inhoud (zowel teksten als afbeeldingen) van dit magazine is auteursrechtelijk beschermd. Niets uit deze uitgave mag vermenigvuldigd of doorgegeven worden aan derden zonder schriftelijke toelating van de uitgever.